
| A. | $\frac{(1{0}^{-8}+1{0}^{-10})}{2}$mol/L | B. | (10-8+10-10)mol/L | ||
| C. | (10-14-5×10-5)mol/L | D. | 2×10-10 mol/L |
分析 常温下,pH=8的NaOH溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-8}}$mol/L=10-6 mol/L,pH=10的KOH溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-10}}$mol/L=10-4 mol/L,二者等体积混合溶液中c(OH-)=$\frac{1{0}^{-6}+1{0}^{-4}}{2}$mol/L,混合溶液中c(H+)=$\frac{1{0}^{-14}}{\frac{1{0}^{-6}+1{0}^{-4}}{2}}$mol/L.
解答 解:常温下,pH=8的NaOH溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-8}}$mol/L=10-6 mol/L,pH=10的KOH溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-10}}$mol/L=10-4 mol/L,二者等体积混合溶液中c(OH-)=$\frac{1{0}^{-6}+1{0}^{-4}}{2}$mol/L,混合溶液中c(H+)=$\frac{1{0}^{-14}}{\frac{1{0}^{-6}+1{0}^{-4}}{2}}$mol/L≈2×10-10 mol/L,故选D.
点评 本题考查pH计算,为高频考点,侧重考查学生分析计算能力,明确溶液中c(H+)、c(OH-)关系是解本题关键,不能直接根据两种碱溶液中c(H+)计算混合溶液中c(H+),很多同学易错选A,题目难度不大.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:选择题
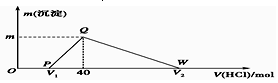
| A. | 原合金质量为0.92 g | |
| B. | 图中V2为60 | |
| C. | 整个滴定过程中Na+的浓度保持不变 | |
| D. | OP段发生的反应为:NaOH+HCl═NaCl+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
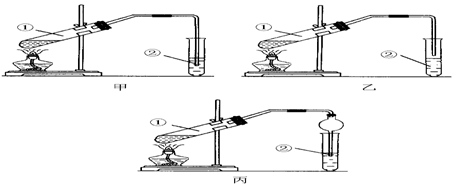
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 molH2(g)和1molO2(g)的总能量小于2mol H2O (l)的能量 | |
| B. | 1 mol H2O (g)分解成H2(g)和O2 (g),吸收241.8kJ能量 | |
| C. | 1mol H2O (l)变成1mo1 H2O (g),吸收88 kJ能量 | |
| D. | 等质量的H2O (g)比H2O(l)所含能量低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CHO (l) | B. | CH3CHO (g) | C. | CO(g) | D. | CO2(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体中一定有甲烷 | B. | 混合气体中一定是甲烷和乙烷 | ||
| C. | 混合气体中可能含有乙烷 | D. | 混合气体中一定没有乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+有较强的吸附性 | |
| B. | Al3+与悬浮物生成沉淀 | |
| C. | Al3+与水反应生成的氢氧化铝胶体,具有吸附性 | |
| D. | 明矾难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com