


科目:高中化学 来源: 题型:
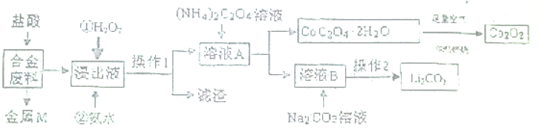
A、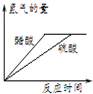 图表示体积和pH值均相同的稀硫酸和醋酸,与足量的镁反应生成H2量的关系 |
B、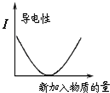 图表示向NaOH溶液中滴加稀盐酸,溶液导电性变化的关系 |
C、 图表示2SO2(g)+O2(g)?2SO3(g)反应过程中,SO2和O2反应速率大小关系 |
D、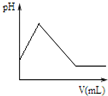 图表示向氨水中滴加稀硫酸时,溶液的pH大小变化关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、每生成1.5mol N2被氧化的气体有3mol |
| B、处理过程中转移的电子数目约为1.339Na |
| C、NOx中x的数值为1.2 |
| D、出去废气中的NOx至少需要氨0.24mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气溶于水:Cl2+H2O═2H++Cl-+ClO- |
| B、醋酸与NaHCO3溶液反应:H++HCO3-=CO2↑+H2O |
| C、将少量铜屑放入浓硝酸中的反应:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O |
| D、氢氧化钡溶液与稀硫酸反应:Ba2++SO42-=BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
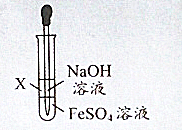
| A、该实验中NaOH溶液往往事先煮沸下,目的是为了赶走其中溶有的O2 |
| B、试剂X可以是食用油、苯或乙醇 |
| C、该实验能较长时间观察到白色沉淀的现象 |
| D、该反应的离子方程式为:Fe2++2OH-=Fe(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属原子与自由电子之间的相互作用 |
| B、金属离子与自由电子之间强烈的相互作用 |
| C、自由电子之间的相互作用 |
| D、金属离子之间的相互作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器 | 起始物质的量/mol | 平衡物质的量/mol | |||
| 编 号 | 温度/℃ | C02 (g) | H2(g) | CH3OH(g) | H2 O(g) |
| I | T1 | 3 | 4 | O.5 | O.5 |
| Ⅱ | T1 | 1.5 | 2 | ||
| Ⅲ | T2 | 3 | 4 | O.8 | O.8 |
| A、若经过2min容器I中反应达平衡,则2min内平均速率(H2)=O.25 mol/(L?min) |
| B、达到平衡时,容器I中C02转化率的比容器Ⅱ的大 |
| C、达到平衡时,容器Ⅲ中反应放出的热量比容器Ⅱ的2倍少 |
| D、若容器I、Ⅱ、Ⅲ中对应条件下的平衡常数分别为K1、K2、K3,则K1=K2<K3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、飓风与海水发生剧烈摩擦,产生的巨大热能使水分子分解,引起氢气燃烧 |
| B、飓风使海水温度升高,产生高温水蒸气,达到水的着火点,使海水燃烧 |
| C、飓风产生高温,使氮气在空气中剧烈燃烧 |
| D、以上说法均有可能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 |
B、 |
C、 |
D、 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com