
����Ŀ����°����ҹ��Ƽҵ�������������ݰ���Ƽ��ȱ������ñ��͵�NaCl��Һ��CO2��NH3��Ӧ��ȡ����������Ƽ��ijѧУ����С����ݺ����Ƽ��ԭ����ʵ����ģ���Ƽ��ͬ���������⣺
(1)д��ʵ������ȡNH3�Ļ�ѧ����ʽ��_______________��
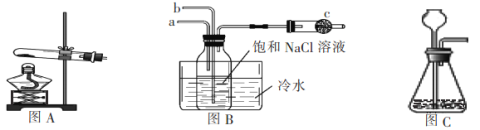
(2)��ͼB�е�a��װ��ͼ_________(��ͼA��ͼC)
(3)�����ӷ���ʽ��ʾװ�б���ʳ��ˮ�ļ���ƿ�е�����______________________��
(4)ˮ���е���ˮ�����ó��˿�������������������Һ�е��ܽ�����һ����Ҫ�����ǣ�_____________��
(5)ͼB��c�������ǣ�_____________��
���𰸡�
(1) Ca(OH)2+2NH4C1=CaCl2+2NH3��+2H2O
(2)A��(3)CO2+NH3+Na++ H2O=NaHCO3��+NH4+
(4)���Ͳ���NaHCO3���ܽ�ȣ�����������
(5)��ֹ������Ⱦ������
��������
��������� (1)ʵ�������Ȼ�狀��������Ƽ�����ȡNH3����Ӧ�Ļ�ѧ����ʽΪCa(OH)2+2NH4C1=CaCl2+2NH3��+2H2O���ʴ�Ϊ��Ca(OH)2+2NH4C1=CaCl2+2NH3��+2H2O��
(2)�ڱ���ʳ��ˮ������ͨ�백������ͨ�������̼���壬������������ˮ��Ϊ�˷�ֹ������ͼB�е�a��װ��ͼA��ͨ�백�����ʴ�Ϊ��A��
(3)���ɵ�̼�������ܽ�Ƚ�С����˻����ɳ�������Ӧ�����ӷ���ʽΪCO2+NH3+Na++ H2O=NaHCO3��+NH4+���ʴ�Ϊ��CO2+NH3+Na++ H2O=NaHCO3��+NH4+��
(4)ˮ���е���ˮ�����ó��˿�������������������Һ�е��ܽ�ȣ�Ҳ�ܽ��Ͳ���NaHCO3���ܽ�ȣ������������ʴ�Ϊ�����Ͳ���NaHCO3���ܽ�ȣ�����������
(5)�����ܹ���Ⱦ��������������ˮ�Ȼ������գ�ͼB��c�������Ƿ�ֹ������Ⱦ�������ʴ�Ϊ����ֹ������Ⱦ������


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ѻ��Ҵ���ͬ���칹�壬�����ɲ��û�ѧ�������������������м����в��ܶԶ��߽��м�������� ��
A�����ý����ƻ��߽�����
B����������
C�����ú������
D�����ú˴Ź�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����ӦA(g)+B(g) ![]() C(g) +D(g)�����е������仯��ͼ��ʾ(E1>0��E2>0)���ش��������⡣
C(g) +D(g)�����е������仯��ͼ��ʾ(E1>0��E2>0)���ش��������⡣

��ͼ�и÷�Ӧ��_________��Ӧ(��������������������)����Ӧ����H�ı���ʽΪ__________��
���ڷ�Ӧ��ϵ�м����������Ӧ��������E1��E2�ı仯�ǣ�E1_________��E2_________(����������������С������������)
��2��������һ�ּ۸�����ij���ȼ�ϣ�����Ҫ�ɷ���̼��������Ԫ�أ�ȼ�պ�ֻ�ж�����̼����̬ˮ������Ի��������Ⱦ����֪1 g������ȫȼ�շų�50.45 kJ���������Իش��������⡣������������ȼ�յ��Ȼ�ѧ����ʽΪ_______________��
��3��C3H8(g)��CH4(g)��HC��CH(g)��H2(g)��H1��+156.6kJ��mol-1��
CH3CH=CH2(g)��CH4(g)+HC��CH(g)��H2��+32.4kJ��mol-1��
����ͬ�����£���Ӧ��C3H8(g)��CH3CH=CH2(g)��H2(g)����H�� kJ��mol-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��������ԭ�ĽǶȷ���ˮ�����л�ѧ��Ӧ��ֻ����ԭ������_______________
A���ˮ B�ƺ�ˮ�ķ�Ӧ(2Na��2H2O===2NaOH��H2��)
C������ˮ��Ӧ(2F2��2H2O===4HF��O2) D������ˮ��Ӧ(Cl2��H2O===HCl��HClO)��
(2)ijһ��Ӧ��ϵ���з�Ӧ��������ﹲ5�����ʣ�S��H2S��HNO3��NO��H2O���÷�Ӧ���л�ԭ������________������Ӧ����ʽ��ת����0.4 mol���ӣ������������������_____ g��
(3)������Cl2ͨ��FeBr2����Һ�У���Ӧ�����ӷ���ʽΪ��2Fe2����Cl2===2Fe3����2Cl���������ʵ˵��Fe2����Cl����Br���������ӻ�ԭ����ǿ����������˳��Ϊ��__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ���������ֵ������������ȷ���ǣ� ��
A. 1mol/L�Ȼ�ͭ��Һ�е�Cu2+��С��NA
B. ��״���£�22.4LCl2��ˮ��Ӧת�Ƶĵ�����ΪNA
C. 28g����ϩ���е�̼ԭ����Ϊ2NA
D. ���Ե缫���ʳ��ˮ������·��ͨ��1NA���ӵ�������������������11.2L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��þ��һ��Ũ�ȵ�ϡ���ᷴӦʱ������Ļ�ԭ����ΪNH4NO3���ֽ�һ������þ��Ͷ��200 ml ϡ�����У�����ǡ����ȫ��Ӧ������Ӧ�����Һ�м��������ŨNaOH��Һ���ȣ���Һ���а�ɫ�������ɣ�ͬʱ�а����ݳ������ݳ��İ��������ȫ����ϡ�������գ�ϡ��������0.17g ���Իش��������⣺
��1������������Ϣд��Mg�����ᷴӦ�Ļ�ѧ����ʽ��____________________��
��2��������ԭ��Ӧ����������ʵ���Ϊ________mol��
��3���μӷ�Ӧ��þ������Ϊ_________g��
��4��ԭϡ��������ʵ���Ũ��Ϊ_________mol��L-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���20mL 0.2mol/LH2A��Һ�еμ�0.2 mol/L NaOH��Һ���й��������ʵ����仯��ͼ(����I����H2A��������HA-��������A2-)��ʾ������ͼʾ�жϣ�����˵����ȷ����
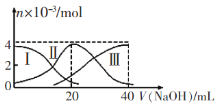
A����V(NaOH)=20 mLʱ����Һ������Ũ�ȴ�С��ϵ�� c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-)
B����Ũ�ȵ�NaOH��Һ��H2A��Һ�����2:1��Ϻ�����Һ��ˮ�ĵ���̶ȱȴ�ˮ��
C��NaHA��Һ�У�c(OH-)=c(H+)+c(HA-)+2c(H2A)
D������������20 mL NaOH��Һ��������Һ���ټ���ˮ�Ĺ����У�pH���ܼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״����ӽ���Ĥȼ�ϵ���н��״�����ת��Ϊ���������ַ�Ӧԭ����

��CH3OH(g)��H2O(g)��CO2(g)��3H2(g) ��H����49.0kJ/mol
��CH3OH(g)��1/2O2(g)��CO2(g)��2H2(g) ��H����192.9kJ/mol
����˵����ȷ����
A��CH3OH��ȼ����Ϊ192.9kJ��mol��1
B����Ӧ���е������仯��ͼ��ʾ
C��CH3OHת���H2�Ĺ���һ��Ҫ��������
D����������֪CH3OH(l)��1/2O2(g)��CO2(g)��2H2(g)����H����192.9kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
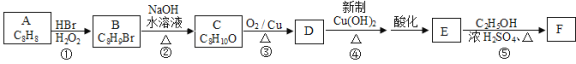
��ش��������⣺
��1��A��һ��������ˮ��Ӧʹ����ɫ�ķ���������ṹ��ʽΪ ��
��2���������ϳ�·�߷����ķ�Ӧ������ȡ����Ӧ���� ���Ӧ��ţ���
��3����Ӧ������ʱ��������H2O2�������ɽ϶��һ�ָ����д�����ָ�����Ľṹ��ʽ ��
��4��д����C��D �� E��Fת���Ļ�ѧ��Ӧ����ʽ �� ��
��5���ڻ�����E����ͬ���칹���У�ֻ����һ�ֺ��������ţ�������FeCl3��Һ������ɫ��Ӧ��ͬ���칹���� �֣��������ǻ���̼̼˫��ֱ������һ���ͬ���칹�壩����дһ���������������Һ˴Ź�����������5�����źŵ�ͬ���칹��Ľṹ��ʽ ��
��6���������ϳ�·�ߵı�����ʽ��д����![]() �Ʊ�
�Ʊ�![]() �ĺϳ�·�ߡ�
�ĺϳ�·�ߡ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com