
| A�� | �����Ƽ���Ƚ�CO2ͨ�뱥��NaCl��Һ����ͨ��NH3 | |
| B�� | ���Ͳ��Ͼ�����ά�����ά�������л��߷��Ӳ��� | |
| C�� | PM2.5��ָ������ֱ����2.5��10-6m�Ŀ�������ܽ�������ͨ����ˮ���պ������ù��˵ķ�������PM2.5���Ϳ����������� | |
| D�� | ����ʮ�����������̼�����մɺ�̼��ά���϶��Ƴɵģ�����һ���������ǽ������� |
���� A������������ˮ����ˮ�����ն�����̼��
B�����ά��Ҫ�ɷ��Ƕ������裻
C����������ֽ�������ù��˵ķ�����
D��̼�����մɺ�̼��ά�ɷǽ���Ԫ����ɣ�
��� �⣺A����ʳ��ˮ��ͨ�������������ͨ������Ķ�����̼������������ˮ����ˮ�ܸ��õ����հ�������A����
B�����ά��Ҫ�ɷ��Ƕ������裬��������Ϊ��������������B����
C����������ֽ�������ù��˵ķ�������C����
D��̼�����մɺ�̼��ά�ɷǽ���Ԫ����ɣ�Ϊ�������ǽ������ϣ���D��ȷ��
��ѡ��D��
���� ���⿼���Ϊ�ۺϣ��漰��ѧ����������������Ŀ��飬Ϊ��Ƶ���㣬��ȷ�����Ƽ�ԭ���������IJ��������ǽ���ؼ�����Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �κλ�ѧ��Ӧ������Ƴ�ԭ��� | |
| B�� | ԭ���������������ԭ��Ӧ | |
| C�� | ԭ����е����������ƶ� | |
| D�� | ��п������ʢ��������Թ��У����뼸���Ȼ�ͭ��Һ�����ݷų����ʼӿ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
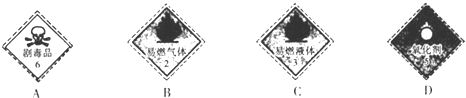
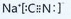 ��
��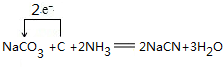 ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
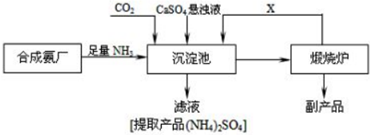
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��H1��0����H2��0 | B�� | 0����H3����H4 | ||
| C�� | 2��H5+��H1��0 | D�� | ��H1=��H2+��H3-2��H5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����£�2A��s��+B��g��=2C��g��+D��g�������Է����У���÷�Ӧ�ʱ�һ�������� | |
| B�� | ͬ��ͬѹ�£�H2��g��+Cl2��g��=2HCl��g���ڹ��������º͵�ȼ�����µġ�H��ͬ | |
| C�� | ��1mol�����ϡ��Һ�뺬1molBa��OH��2��ϡ��Һ��ȫ�к����ų�������Ϊ�к��� | |
| D�� | ��25�桢101KPaʱ��2mol ������ȼ������1mol ������2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ۢ� | B�� | �ڢۢ� | C�� | �ڢ� | D�� | �٢ܢ� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com