
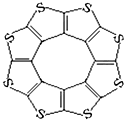
 最近尼赫鲁先进科学研究中心借助ADF软件对一种新型环烯类储氢材料(C16S8)进行研究,从理论角度证明这种分子中的原子都处于同一平面上(结构如图所示),每个平面上下两侧最多可储存10个H2分子.
最近尼赫鲁先进科学研究中心借助ADF软件对一种新型环烯类储氢材料(C16S8)进行研究,从理论角度证明这种分子中的原子都处于同一平面上(结构如图所示),每个平面上下两侧最多可储存10个H2分子.| C-S | C=S | C16S8中碳硫键 | |
| 键长/pm | 181 | 155 | 176 |
分析 ①一般来说,周期表从左到右,元素的电负性逐渐变大;周期表从上到下,元素的电负性逐渐变小.电负性大的元素集中在元素周期表的右上角,电负性小的元素集中在左下角;
②对于有机物利用杂化轨道数=孤对电子对数+σ键数进行判断;当n=2,sp杂化;n=3,sp2杂化;n=4,sp3杂化;
③根据键长数据分析;
④分子与分子间的作用力为分子间作用力.
解答 解:①元素周期表中同周期元素从左到右元素的电负性逐渐增强,同主族元素从上到下元素的电负性逐渐减弱,所以元素的电负性是指元素的原子在化合物中把电子吸引向自己的本领,元素的非金属性强者电负性大,其单质的最高价氧化物对应的水化物的酸性越强,H2CO3的酸性远不及H2SO4的酸性强,所以元素电负性C略小于S,
故答案为:<;
②根据图2结构可知:碳原子形成2个C-S,1个C=S二键,C原子杂化轨道数为(2+1)=3,C原子采取sp2杂化方式,
故答案为:sp2;
③C-S键长为181pm,C=S键长为155pm,C16S8中碳硫键键长为176pm,键长介于C-S与C=S之间,原因可能是:分子中的C与S原子之间有π键或分子中的碳硫键具有一定程度的双键性质,
故答案为:分子中的C与S原子之间有π键或分子中的碳硫键具有一定程度的双键性质;
④分子之间存在范德华力,C16S8与H2微粒间的作用力是范德华力,故答案为:范德华力.
点评 本题考查烯类储氢材料有关知识,涉及元素电负性大小、原子的杂化轨道类型、微粒间的作用力等知识点,题目难度中等,注意杂化轨道数判断,为高频考点.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 以乙烯为原料可以合成聚乙烯等制备生活用品的材料 | |
| B. | 乙烯可以用来制备1,2-二氯乙烷(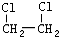 ) ) | |
| C. | 乙烯可以与水发生加成反应制备乙醇(CH3CH2OH) | |
| D. | 乙烯可以与Br2发生加成反应制备二溴乙烷(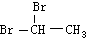 ) ) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酸性高锰酸钾溶液除去乙烷中的乙烯 | |
| B. | 用苯与浓溴水在FeBr3催化作用下制溴苯 | |
| C. | 用食醋浸泡有水垢的水壶清除其中的水垢 | |
| D. | 用乙醇从碘水中萃取碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 N2H+5+OH-.
N2H+5+OH-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上制粗硅并提纯 | |
| B. | 用FeCl3溶液作为“腐蚀液”刻蚀电路铜板 | |
| C. | 实验室制CO2 | |
| D. | 用Na2O2作潜水艇的供氧剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只用溴水一种试剂鉴别苯、己烯、乙醇、四氯化碳 | |
| B. | 用银氨溶液或NaHCO3溶液鉴别甲酸甲酯和乙酸两种液体 | |
| C. | 用核磁共振氢谱鉴别1-溴丙烷和2-溴丙烷 | |
| D. | 用KMnO4酸性溶液鉴别CH3CH=CHCH2OH和CH3CH2CH2CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO(g)的燃烧热是283.0 kJ•mol-1,则2CO2(g)═2CO(g)+O2(g)反应的△H=+566.0 kJ | |
| B. | H2SO4和NaOH反应的中和热△H=-57.3 kJ•mol-1,则1molH2SO4和1molBa(OH)2反应的反应热△H=-114.6kJ•mol-1 | |
| C. | 石墨转化为金刚石是吸热反应,可知金刚石的燃烧热更大 | |
| D. | 在恒温时,压缩容器的体积,则2SO2+O2?2SO3平衡正向移动,该反应的△H减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用NH3•H2O溶液鉴别Al3+、Mg2+和Ag+ | |
| B. | 用水鉴别乙醇、甲苯和溴苯 | |
| C. | 用Ba(NO3)2溶液鉴别Cl-、SO42-和CO32- | |
| D. | 用澄清石灰水鉴别CO、CO2、SO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com