
短周期元素X、Y、Z 所在的周期数依次增大,它们的原子序数之和为20,且Y2-与Z+核外电子层的结构相同。下列化合物中同时存在离子键和非极性共价键的是
A.Z2Y B.X2Y2 C.Z2Y2 D.ZYX
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源:2015-2016学年内蒙古平煤高中高一实验班下期中化学卷(解析版) 题型:填空题
按要求写出:
(1)一核10电子的阳离子的符号_________;
(2)两核10电子的阴离子的电子式___________;
(3)三核10电子的共价化合物的电子式_______;
(4)四核10电子的阳离子的电子式:__________;
(5)四核10电子的共价化合物的结构式_________;
(6)五核10电子的阳离子的化学式___________;
(7)五核10电子的共价化合物的结构式___________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁庄河高中高一下期中化学试卷(解析版) 题型:选择题
根据表中有关短周期元素性质的数据,判断下列说法中正确的是( )
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
原子半径 | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
-2 | -3 | -1 | -3 |
A.元素②与元素③处于同一周期
B.元素④的原子序数小于元素⑦的
C.元素⑧的还原性比元素⑥的强
D.元素⑤的最高价氧化物对应水化物的酸性最强
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽六安一中高一下周末作业四化学试卷(解析版) 题型:选择题
钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为:2Fe+2H2O+O2═2Fe(OH)2。以下说法正确的是
A.负极发生的反应为:Fe-2e-=Fe2+
B.正极发生的反应为:2H2O+O2+2e-=4OH-
C.原电池是将电能转变为化学能的装置
D.钢柱在水下部分比在水面处更容易腐蚀
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽六安一中高一下周末作业四化学试卷(解析版) 题型:选择题
下图是一个一次性加热杯的示意图。当水袋破裂时,水与固体碎块混和,杯内食物温度逐渐上升。制造此加热杯可选用的固体碎块是
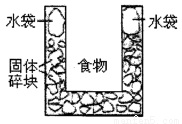
A.硝酸铵 B.生石灰 C.氯化镁 D.食盐
查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(浙江卷参考版) 题型:填空题
化合物X是一种有机合成中间体,Z是常见的高分子化合物,某研究小组采用如下路线合成X和Z。
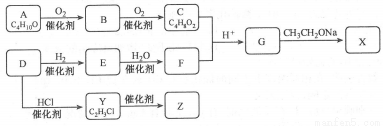
已知:①化合物A的结构中有2个甲基
②RCOOR’+R’CH2COOR’ 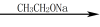
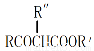
请回答:
(1)写出化合物E的结构简式__________,F中官能团的名称是_________。
(2)Y→Z的化学方程式是____________。
(3)G→X的化学方程式是__________,反应类型是___________。
(4)若C中混有B,请用化学方法检验B的存在(要求写出操作、现象和结论)_________。
查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(浙江卷参考版) 题型:选择题
下列说法不正确的是
A.储热材料是一类重要的能量存储物质,单位质量的储热材料在发生熔融或结晶时会吸收或释放较大的热量
B.Ge(32号元素)的单晶可以作为光电转换材料用于太阳能电池
C.Ba2+浓度较高时危害健康,但BaSO4可服人体内,作为造影剂用于X-射线检查肠胃道疾病
D.纳米铁粉可以高效地去除被污染水体中的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其本质是纳米铁粉对重金属离子较强的物理吸附
查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(江苏卷参考版) 题型:选择题
根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤,下列图示装置和原理能达到实验目的的是
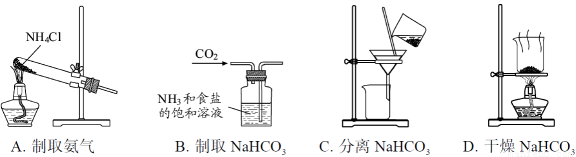
查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(全国2卷参考版) 题型:填空题
[化学--选修3:物质结构与性质]
东晋《华阳国志南中志》卷四种已有关于白铜的记载,云南镍白铜(铜镍合金)文明中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为_________,3d能级上的未成对的电子数为______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是_____。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为______- ,提供孤电子对的成键原子是_____。
③氨的沸点(“高于”或“低于”)膦(PH3),原因是______;氨是_____分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______。
(3)单质铜及镍都是由______键形成的晶体:元素同与镍的第二电离能分别为:ICu=1959kJ/mol,INi=1753kJ/mol,ICu>INi的原因是______。
(4)某镍白铜合金的立方晶胞结构如图所示。
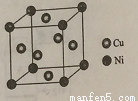
①晶胞中铜原子与镍原子的数量比为_____。
②若合金的密度为dg/cm3,晶胞参数a=________nm
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com