
| 物质 | H2(g) | CO2(g) | CH2=CH2 | H2O(g) |
| 能量:KJ/mol | 0 | -394 | 52 | -242 |

 ;△H<0
;△H<0分析 (1)焓变等于生成物总能量减去反应物总能量;
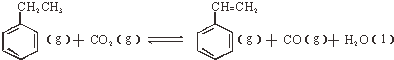
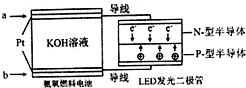
(2)①根据图知,生成氧气的电极是阳极,则连接阳极的电源电极为正极;
②阴极上二氧化碳得电子和氢离子反应生成丙烯和水;
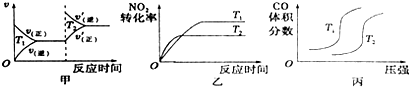
(3)①根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆速率之比等于化学计量数之比(不同物质),各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化;
②根据图I中乙苯的浓度变化,求出反应速率;
②根据图I中实验Ⅲ改变条件平衡逆向移动,反应速率增大,达平衡时间缩短;
③再通入CO2和乙苯各1mol,相当于减少二氧化碳的量,平衡逆向移动,重新达到平衡时,乙苯的转化率将减少;平衡由于温度没变K值不变,用原平衡I计算:K$\frac{0.6×0.6}{0.4×2.4}$=0.375.
解答 解:(1)焓变等于生成物总能量减去反应物总能量,则该反应的焓变=[52+(-242)×4-(-394)×2-0]kJ/mol=-128kJ/mol,故答案为:-128kJ/mol;(1)-128KJ/mol(2分)
(2)①根据图知,生成氧气的电极是阳极,则连接阳极的电源电极为正极,所以b为正极,
故答案为:正极;
②阴极上二氧化碳得电子和氢离子反应生成丙烯和水,电极反应式为3CO2+18H++18e-=CH3CH=CH2+6H2O,故答案为:3CO2+18H++18e-=CH3CH=CH2+6H2O;
(3)①a.反应前后体积不变,质量守恒,所以体系的密度始终不变,故不能用密度判断平衡,故a错误;
b.c(CO2)与c(CO)的浓度是否相等,与反应的起始量和转化率有关,所以当c(CO2)=c(CO)时,不能说明已经达到平衡状态,故b错误;
c.消耗1molCO2为正速率,同时生成1molH2O也是正速率,都是正速率,二者始终相等,不能说明已经达到平衡状态,故c错误;
d.随着反应的进行CO2的体积分数逐渐减小,当CO2的体积分数保持不变,即是平衡状态,故d正确;
所以不能说明已达到平衡状态的是ad,
故答案为:ad;
②根据图I中可知,0-50min时乙苯的浓度变化为1.0mol/L-0.4mol/L=0.6mol/L,
则其反应速率为$\frac{△c}{t}$=$\frac{0.6mol/L}{50min}$=0.012mol/(L•min);
故答案为:0.012mol/(L•min);
②根据图I中实验Ⅲ改变条件平衡逆向移动,反应速率增大,达平衡时间缩短,所以改变的条件是升高温度,
故答案为:升高温度.
③再通入CO2和乙苯各1mol,相当于减少二氧化碳的量,平衡逆向移动,重新达到平衡时,乙苯的转化率将减少;平衡由于温度没变K值不变,用原平衡I计算:K$\frac{0.6×0.6}{0.4×2.4}$=0.375,故答案为:减少;0.375.
点评 本题综合性较大,涉及化学平衡状态的判断、化学平衡常数、化学平衡影响因素、反应速率的计算等,题目涉及的内容较多,侧重于考查学生对知识点的综合应用能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成17.6 g硫化亚铁时,放出19.12 kJ热量,则Fe(s)+S(s)═FeS(s)△H=-95.6 kJ•mol-1 | |
| B. | 稀醋酸与0.1 mol•L-1 NaOH溶液反应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1 | |
| C. | 已知1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式为2H2O(l)═2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| D. | 已知2C(s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,则可知C的燃烧热△H=-110.5 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 浓度/mol.L-1/时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

难溶物 | NiS | ZnS | CuS | CaF2 | MgF2 |
| 溶度积常数 | 1.07×10-21 | 2.93×10-25 | 1.27×10-36 | 1.46×10-10 | 7.42×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 古诗或谚语 | 含有的化学反应类型 |
| A | 爆竹声中除旧岁,春风送暖入屠苏 | 复分解反应 |
| B | 千锤万凿出深山,烈火焚烧若等闲 | 分解反应 |
| C | 春蚕到死丝方尽,蜡炬成灰泪始干 | 化合反应 |
| D | 真金不怕火,怕火便是铜 | 置换分解反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的沸点:Y>Z | |
| B. | X、Y、Z三种元素不可能形成离子化合物 | |
| C. | X的最高价氧化物对应的水化物的酸性比W的强 | |
| D. | Y分别与Z、W形成的化合物中化学键类型不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C8H10含苯环的烃同分异构体有3种 | |
| B. | 结构为…-CH=CH-CH=CH-CH=CH-CH=CH-…的高分子化合物,其单体是乙烯 | |
| C. | 苯中含有杂质苯酚,可用浓溴水来除杂 | |
| D. | 丙烯酸(CH2=CHCOOH)和山梨酸(CH3CH=CHCH=CHCOOH)不是同系物,它们与氢气充分反应后的产物是同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去蛋白质中的葡萄糖,可以用浓硫酸铵溶液盐析过滤方法提纯 | |
| B. | 双氧水中滴加氯化铁溶液立即产生气泡,说明氯化铁的氧化性比过氧化氢强 | |
| C. | 锂钒氧化物蓄电池放电时电池的总反应式为:V2O5+xLi═LixV2O5.供电时Li+向正极移动,充电时阳极的电极反应式为:LixV2O5-xe-═V2O5+xLi+ | |
| D. | 常温下,Mg(OH)2能溶于氯化铵浓溶液的主要原因是NH4+结合OH-使沉淀溶解平衡发生移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
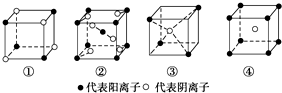
| A. | ①MR ②MR2 ③MR3 ④MR4 | B. | ①MR ②MR2 ③MR2 ④MR | ||
| C. | ①MR2 ②MR2 ③MR2 ④MR | D. | ①MR ②MR ③MR2 ④MR2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com