
【题目】中学常见的某反应化学方程式为X +Y→M+N +H2O(未配平,反应条件已略去),下列叙述错误的是
A. 若X、Y的物质的量之比为1:4,且N是黄绿色气体,则该反应的离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
B. 若M、N为气体,且都能使澄清石灰水变浑浊,则将此混合气体通入溴水中,橙色褪色,橙色褪色过程的离子方程式为SO2+Br2+2H2O=4H++SO42-+2Br-
C. 若X是铁,Y是稀硝酸(过量),则X与Y反应的离子方程式为Fe+4H++NO3- = Fe3+ +NO↑+2H2O
D. 当N为氯碱工业的主要原料,M是造成温室效应的主要气体,则上述反应的离子方程式一定为:CO32-+2H+=CO2↑+H2O
【答案】D
【解析】A. 若X、Y的物质的量之比为1:4,且N是黄绿色气体,N是氯气,则该反应的离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O,A正确;B. 能使澄清石灰水变浑浊的气体有二氧化碳、二氧化硫,单质碳可以和浓硫酸反应生成二氧化碳和二氧化硫,其中SO2能使溴水褪色,褪色过程的离子方程式为SO2+Br2+2H2O=4H++SO42-+2Br-,B正确;C. 硝酸可以将金属铁氧化到最高价,稀硝酸对应的还原产物是NO,金属铁可以和硝酸铁反应生成硝酸亚铁,金属铁和过量的硝酸反应的方程式为Fe+4H++NO3-=Fe3++NO↑+2H2O,C正确;D. 氯化钠为氯碱工业的主要原料,二氧化碳是造成温室效应的主要气体之一,碳酸钠、碳酸氢钠均可以和盐酸反应生成二氧化碳和水,D错误,答案选D。
Mn2++Cl2↑+2H2O,A正确;B. 能使澄清石灰水变浑浊的气体有二氧化碳、二氧化硫,单质碳可以和浓硫酸反应生成二氧化碳和二氧化硫,其中SO2能使溴水褪色,褪色过程的离子方程式为SO2+Br2+2H2O=4H++SO42-+2Br-,B正确;C. 硝酸可以将金属铁氧化到最高价,稀硝酸对应的还原产物是NO,金属铁可以和硝酸铁反应生成硝酸亚铁,金属铁和过量的硝酸反应的方程式为Fe+4H++NO3-=Fe3++NO↑+2H2O,C正确;D. 氯化钠为氯碱工业的主要原料,二氧化碳是造成温室效应的主要气体之一,碳酸钠、碳酸氢钠均可以和盐酸反应生成二氧化碳和水,D错误,答案选D。


科目:高中化学 来源: 题型:
【题目】一定质量的钠、钾投入一定量的稀盐酸中,产生气体随时间变化的曲线如下图所示,则下列说法中正确的是
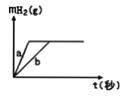
A. 投入的Na、K一定等质量
B. 投入的Na的质量大于K的质量
C. 曲线a为K,b为Na
D. 稀盐酸的量一定是不足量的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有些物质既能与强酸溶液反应又能与强碱溶液反应,下列物质不具有此类性质的是
A. NaHCO3 B. (NH4)2CO3 C. Al D. AlCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的叙述正确的是
A. 分子式相同而结构不同的化合物互称为同分异构体
B. 凡是分子组成相差一个或几个CH2原子团的物质,彼此一定是同系物
C. 两种化合物组成元素相同,各元素质量分数也相同,则两者一定是同种物质
D. 羧基、醛基、羟基、乙基都属于有机物的官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知硼、氮、钴、铜是几种重要的元素,请回答下列向题:
(1)Co的基态原子中未成对电子数为________个;Cu的基态原子的电子排布式为_______。
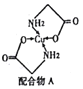
(2)Cu的配合物A的结构如右图,A中所含C、N、O三种元素的第一电离能由大到小的顺序为________。其中氮原子的杂化方式是_______________。
(3)配体氨基乙酸根(H2NCH2COO-)受热分解可产生CO2 和N2, N2中δ键和π键数目之比是________;N2O与CO2互为等电子体,结构相似,且N2O分子中O只与一个N相连,则N2O的电子式为________。
(4)立方氮化硼的晶胞结构与金刚石结构相似(如下图),是超硬材料。

①晶胞中每个氮原子周围与其最近且等距离的硼原子有________个;
②结构化学上常用原子坐标参数表示晶胞内部各原子的相对位置,立方氮化翻的晶胞中,B原子的坐标参数分别有:B (0,0,0);B(![]() ,0,
,0, ![]() );B (
);B (![]() ,(
,(![]() ,
, ![]() ,0)等,则距离上述三个B原子最近且等距离的N原子的坐标参数为_________;
,0)等,则距离上述三个B原子最近且等距离的N原子的坐标参数为_________;
③已知氮化硼晶胞边长为apm,则氮化硼的密度为_______g·cm -3(设NA为阿伏加德罗常数值,只要求列算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质能按照如图关系图(“→”表示反应一步完成)相互转化的是

A | B | C | D | |
X | NaOH | Cu | Fe2O3 | Ca(OH)2 |
Y | NaNO3 | CuO | Fe | CaCl2 |
Z | Na2SO4 | Cu(OH)2 | FeCl2 | CaCO3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欧洲、美国、日本已构成世界上最先进的香料香精工业中心,并且以香精为龙头产品带动天然香料和合成香料的发展。我国食用香精香料行业呈现外资企业和民营企业两强争霸的剧烈竞争态势。某芳香化合物的结构简式如图:该物质的苯环上的n溴代物的同分异构体的数目和m溴代物的同分异构体的数目相等,则n和m一定满足的关系式是 ( )
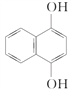
A. n+m=8 B. n+m=7 C. 2n=m D. n+m=6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用卤块(主要成分为MgCl2·6H2O,含有MgSO4.FeCl2等杂质)制备少量Mg(ClO3)2·6H2O的流程如下:
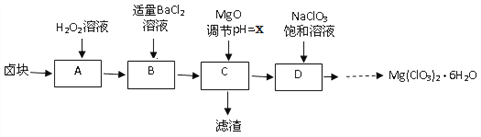

已知:①四种化合物的溶解度(S)随温度(T)变化曲线如图所示。
②室温时一些物质的Ksp如下表:
化学式 | Fe(OH)2 | Fe(OH)3 | Mg(OH)2 |
Ksp | 8.0×10-16 | 8.0×10-38 | 1.8x10-11 |
③Mg(ClO3)2有较强的氧化性,其还原产物是Cl-.
(1)H2O2的电子式为_________
(2)滤渣的成分是____________(填化学式);
(3)经测定,D中铁离子的浓度为1×10-5 mol/L,则x为______
(4)D中所发生的化学反应方程式为_____,框图中由D→......→制Mg(ClO3)2·6H2O晶体的实验步骤依次为:①加热蒸发;②_______(请补充);③冷却结晶;④过滤洗涤。
(5)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10.00 mL试液于锥形瓶中,加入10.00 mL稀硫酸和20 .00mL 1.000 mol/L的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol/L K2Cr2O7溶液滴定剩余的Fe2+至终点。
步骤4:将步骤2、3重复两次
①步骤3中发生反应的离子方程式____________
②步骤3中若滴定前不用标准液润洗滴定管,将会导致最终结果_____(填“偏大”. “偏小”或“不变”)。
③若平均消耗K2Cr2O7溶液15.00 mL,则产品中Mg(ClO3)2·6H2O(其M=299g/mol)的质量分数为___________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com