
| 选项 | 试剂 | 操作及现象 |
| A | 氯水 | 滴加NaOH溶液,溶液颜色褪去,再加浓盐酸,溶液颜色恢复 |
| B | CaCl2 | 向两支盛有CaCl2溶液的试管中分别通入CO2和CO,均无沉淀产生 |
| C | AgNO3 | 滴加氨水,产生沉淀,继续滴加氨水,沉淀溶解 |
| D | 铝粉 | 滴加NaOH溶液,产生气体,继续滴加,产生白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氯水与NaOH反应后为无色,再加盐酸,氯离子、次氯酸根离子发生氧化还原反应生成氯气;
B.CO2和CO均与氯化钙不反应;
C.先反应生成AgOH,后生成银氨溶液;
D.Al与NaOH溶液反应生成偏铝酸钠和氢气.
解答 解:A.氯水与NaOH反应后为无色,再加盐酸,氯离子、次氯酸根离子发生氧化还原反应生成氯气,则溶液颜色恢复,故A正确;
B.CO2和CO均与氯化钙不反应,则均无沉淀产生,故B正确;
C.先反应生成AgOH,后生成银氨溶液,则滴加氨水,产生沉淀,继续滴加氨水,沉淀溶解,故C正确;
D.Al与NaOH溶液反应生成偏铝酸钠和氢气,则产生气体,继续滴加,无沉淀,故D错误;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应及现象为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度不大.


 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:选择题
| A. | N2既是氧化剂,又是还原剂 | |
| B. | NaNO2是氧化剂,氧化产物、还原产物都是N2 | |
| C. | NH4Cl中的氮元素被还原 | |
| D. | 每生成1 mol N2时,转移电子的物质的量为6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 molCl2与足量Fe反应转移电子数为0.3NA | |
| B. | 标况下,11.2L 氟化氢中含有的分子数目为0.5NA | |
| C. | 常温常压下,4.2g环丙烷和聚乙烯的混合物中含有的碳原子数为0.3 NA | |
| D. | 25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液与氢氧化钠溶液反应的离子方程式为H++OH-═H2O | |
| B. | H2O的电离方程式:H2O+H2O?H3O++OH- | |
| C. | 甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O (g)△H=-890.3 kJ•mol-1 | |
| D. | 双氧水中加入稀硫酸和KI溶液:H2O2+2I-+H+═I2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Kp=$\frac{P(N{H}_{3})^{4}×P({O}_{2})^{5}}{P(NO)^{4}×P({H}_{2}O)^{6}}$ | |
| B. | 升高温度,若Kp增大,则该反应为吸热反应 | |
| C. | 该反应达到平衡状态后,增大压强,平衡向左移动,Kp减小 | |
| D. | 2NH3(g)+$\frac{5}{2}$O2(g)?2NO(g)+3H2O(g) 的平衡常数Kp=($\frac{1}{2}$)a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(A2-)>c(H2A) | B. | c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-) | ||
| C. | c(Na+)=c( HA-)+c(H2A) | D. | c(H+)=c(A2-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
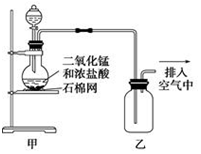
| A. | 该装置图中至少存在两处明显错误 | |
| B. | 在乙后连一盛有饱和食盐水的烧杯可进行尾气处理 | |
| C. | 烧瓶中的MnO2可换成KMnO4 | |
| D. | 在集气瓶的导管口处放一片湿润的淀粉--KI试纸可以证明是否有氯气逸出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
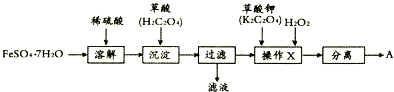
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com