
 过氧化氢(H2O2)是淡蓝色的黏稠液体,水溶液为无色透明液体,俗称双氧水,可以看作二元弱酸.
过氧化氢(H2O2)是淡蓝色的黏稠液体,水溶液为无色透明液体,俗称双氧水,可以看作二元弱酸.分析 (1)H2O2可以看作二元弱酸,可分步电离;
(2)H2O2还原产物为水;
(3)胶体具有丁达尔效应;亚铁离子具有还原性,与过氧化氢发生氧化还原反应;
(4)①根据溶液呈电中性,溶液中阳离子所带的正电荷总数等于溶液中阴离子所带的负电荷总数进行解答;
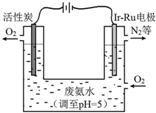
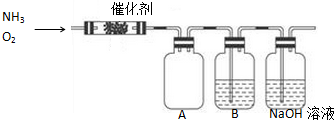
②在该电解池中,Ir-Ru惰性电极有吸附O2作用为氧气得电子发生还原反应,在酸性条件下生成过氧化氢;
③根据4NH3+3O2?2N2+6H2O,每转移12mol电子,处理4mol氨气,据此分析解答.
解答 解:(1)H2O2可以看作二元弱酸,可分步电离,电离方程式为H2O2?H++HO2-、HO2-?H++O22-,故答案为:H2O2?H++HO2-、HO2-?H++O22-;
(2)H2O2还原产物为水,对环境没有污染,为绿色氧化剂,故答案为:其还原产物是H2O,对环境无污染;
(3)胶体具有丁达尔效应,可用丁达尔效应检验胶体,亚铁离子具有还原性,与过氧化氢发生氧化还原反应,反应的离子方程式为2Fe2++H2O2+4H2O=2Fe(OH)3(胶体)+4H+,
故答案为:丁达尔效应;2Fe2++H2O2+4H2O=2Fe(OH)3(胶体)+4H+;
(4)①向废氨水加入适量硝酸调节溶液的pH约为5,根据溶液呈电中性,溶液中c(NH4+)+c(H+)=c(NO3-)+c(OH-),pH约为5呈酸性,c(H+)>c(OH-),所以c(NH4+)<c(NO3-),
故答案为:<;
②利用电解法制H2O2,在该电解池中,Ir-Ru惰性电极有吸附O2作用为氧气得电子发生还原反应,O2+2H++2e-═H2O2,故答案为:O2+2H++2e-=H2O2;
③4NH3+3O2?2N2+6H2O中,氨气中的氮元素从-3价变为氮气中的0价,4mol氨气转移12mol电子,所以转移3mol电子,最多可以处理NH3的物质的量为1mol,质量为17g,
故答案为:17.
点评 本题考查较为综合,侧重于学生的分析、计算能力的考查,题目涉及双氧水的性质,难度不大,熟悉双氧水的结构和性质是解题关键,注意双氧水中氧元素化合价处于中间价态,所以既有氧化性,又有还原性.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe3+、Na+、SCN-、Cl- | B. | Na+、H+、NO3-、SO42- | ||
| C. | Na+、OH-、H+、NO3- | D. | Fe2+、NH4+、Cl-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
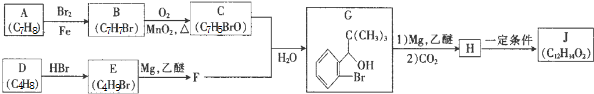
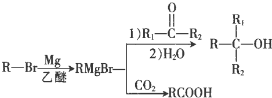
 +Br2$\stackrel{铁粉}{→}$
+Br2$\stackrel{铁粉}{→}$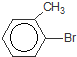 +HBr.,其反应类型为取代反应;
+HBr.,其反应类型为取代反应;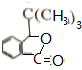 ,由D生成E的化学反应方程式为CH2=C(CH3)2+HBr→(CH3)3CBr;
,由D生成E的化学反应方程式为CH2=C(CH3)2+HBr→(CH3)3CBr;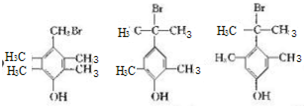 (其中一种)(写出一种即可).
(其中一种)(写出一种即可).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
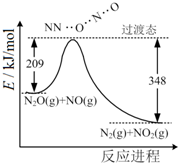
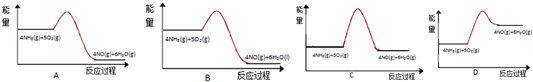
| A. | 反应生成1mol N2时转移4mole- | |
| B. | 反应物能量之和大于生成物能量之和 | |
| C. | N2O(g)+NO(g)═N2(g)+NO2(g)△H=-139 kJ/mol | |
| D. | 断键吸收能量之和小于成键释放能量之和 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 物质名称 | 氯气 | 小苏打 | 二氧化硅 | 氧化铁 |
| 用途 | 制漂白粉 | 治疗胃酸过多 | 制半导体材料 | 用作红色涂料 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 麦芽糖水解的产物只有葡萄糖 | |
| B. | 苯酚可用于合成高分子化合物 | |
| C. | 油脂水解可以制取高级脂肪酸 | |
| D. | 鸡蛋清遇醋酸铅后产生的沉淀能重新溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com