
本题包括A、B 两小题,请选定其中一小题,并在相应的答题区域内作答。若多做,则按A小题评分。
A.[物质结构与性质]
氮元素可形成氢化物、卤化物、氮化物、叠氮化物和配合物等多种化合物。
(1)肼(N2H4)可用作火箭燃料,其原理是:N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g),若反应中有4mol N-H键断裂,则形成的π键有 ▲ mol。
(2) F2和过量NH3在铜催化作用下反应生成NF3,NF3分子的空间构型为 ▲ 。
(3)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构见图13。写出该反应的化学方程式: ▲ 。

 | |||||
 | |||||
|
(4)叠氮化钠(NaN3)分解反应为:2NaN3(s)=2Na(l)+3N2(g),下列有关说法正确的是
▲ (填序号)。
a.常温下,N2很稳定,是因为N的电负性大
b.钠晶胞结构见图14,每个晶胞含有2个钠原子
c.第一电离能(I1):N>O>P>S
d.NaN3与KN3结构类似,晶格能:NaN3<KN3
(5)配合物Y的结构见图15,Y中含有 ▲ (填序号);
a.极性共价键 b.非极性共价键 c.配位键 d.氢键
Y中碳原子的杂化方式有 ▲ 。
科目:高中化学 来源: 题型:
将装有50 mL NO2和NO混合气体的量筒倒立于水槽中,反应后气体体积缩小为30 mL,则原混合气体中NO2和NO的体积比是( )
A.5∶3 B.3∶5 C.3∶2 D.2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
高温油炸食品中常含有害物质丙烯酰胺( )。下列关于丙烯酰胺的叙述错误的是
)。下列关于丙烯酰胺的叙述错误的是
A.属于氨基酸
B.能使酸性KMnO4溶液褪色
C.能发生加聚反应生成高分子化合物
D.与H2N—CH==CHCHO互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池,RFC工作原理见图5。下列有关说法正确的是
A.转移0.1mol电子时,a电极产生标准状
况下O2 1.12L
B.b电极上发生的电极反应是:
2H2O+2e-=H2↑+2OH-
C.c电极上进行还原反应,B池中的H+可以
通过隔膜进入A池
D.d电极上发生的电极反应是:O2+4H++4e-=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
重铬酸钾(K2Cr2O7)是工业上重要的氧化剂,实验室利用铬铁矿(主要成份为FeO·Cr2O3)模拟工业生产制备重铬酸钾的主要工艺如下:
| |||||||||||||||||
 |  | ||||||||||||||||
|
| ||||||||||||||||
| |||||||||||||||||
 | |||||||||||||||||
| |||||||||||||||||
| |||||||||||||||||
(1) 铬铁矿中的SiO2和Al2O3在反应器中与纯碱共热反应转变为可溶性盐,写出Al2O3与碳酸钠反应的化学方程式: ▲ 。
|
 6FeO·Cr2O3+24NaOH+7KClO3 12Na2CrO4+3Fe2O3 +7KCl+12H2O。
6FeO·Cr2O3+24NaOH+7KClO3 12Na2CrO4+3Fe2O3 +7KCl+12H2O。
Fe2O3可进一步转化为NaFeO2。NaFeO2在操作Ⅰ中强烈水解,写出NaFeO2水解的化学方程式: ▲ 。
(3)操作Ⅱ的目的是 ▲ 。
(4)操作Ⅲ中CrO42-转化为Cr2O72-,写出此可逆反应的离子方程式:
▲ 。
(5)称取重铬酸钾试样2.5000g配成250mL溶液,取出25.00mL于锥形瓶中,加入10mL 2mol·L-1H2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol·L-1Na2S2O3标准溶液滴定至滴定终点时用去Na2S2O3溶液40.00mL(I2+2S2O32-=2I-+S4O62-)。
①写出重铬酸钾与碘化钾反应的离子方程式: ▲ ;
②重铬酸钾试样的纯度(设整个过程中其它杂质不参与反应)为 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化还原反应是重要的反应类型,下列有关说法正确的是
A.1molAl和足量的NaOH溶液反应,失去的电子数为3NA(NA表示阿伏加德罗常数)
B.原电池的负极发生氧化反应,电解池的阳极发生还原反应
C.Cu能被FeCl3溶液腐蚀,其离子方程式为:Cu+Fe3+==Cu2++Fe2+
D.Na+、Ba2+、NO3-、SO32-四种离子在溶液中因发生氧化还原反应而不能大量共存
查看答案和解析>>
科目:高中化学 来源: 题型:
【化学一选修5有机化学基础】(12分)
扑热息痛(学名对乙酸氨基酚)是生活中常用到的一种解热镇痛药。以苯为原料合成扑热息痛的部分转化如下: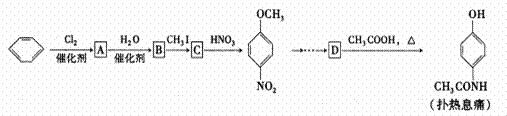
请回答下列问题:
(1)B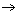 C的反应类型为 ,D中官能团的名称为 。
C的反应类型为 ,D中官能团的名称为 。
(2)C的结构简式为 。
(3)1mol扑热息痛与足量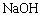 溶液反应,理论上消耗
溶液反应,理论上消耗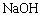 的物质的量为 mol。
的物质的量为 mol。
(4)实验证明B能够与溴水反应,试写出其反应的化学方程式
。
(5)扑热息痛有多种同分异构体,同时符合下列要求的同分异构体有 种。
①苯环上有两个对位取代基;②同于氨基酸。
查看答案和解析>>
科目:高中化学 来源: 题型:
由周期不同的短周期元素X、Y组成的化合物A,是良好的耐热冲击材料。已知A的化学式为XY,且X的阳离子和Y的阴离子具有相同的核外电子排布。
(1)X的单质既可与盐酸反应,又可与NaOH溶液反应,X的原子结构示意图为 。
(2)X的硫酸盐溶液与过量NaOH溶液反应的离子方程式为 。
(3)一定条件下,A和水缓慢作用生成含Y的化合物Z,Z分子含有10个电子。
①Z与H2O2反应,其产物之一是Y的单质,Y 的单质的电子式为 ;
②A的化学式是 。
(4)X的单质、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的化合物均由两种元素组成,且都是新型陶瓷材料(在火箭和导弹上有重要应用),其反应的化学方程式是______ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com