
【题目】以甲苯和有机物A为原料,合成高分子化合物M的一种路线如下(部分反应条件略去):

已知:①A的实验式为CH3O
② (-NH2容易被氧化)
(-NH2容易被氧化)
③
④ (R和R’代表烃基)
(R和R’代表烃基)
请回答下列问题:
(1)A的化学名称为_______________,检验B中所含官能团的试剂名称为____________。
(2)G的顺式结构简式为________________、____________。
(3)D→E,H→I的反应类型分别为______________________。
(4)C+J→M的化学方程式为____________________________。
(5)同时满足下列条件的F的同分异构体有_____________种(不考虑立体异构)。
①含有![]()
②两个—NO2分别连在两个不同的苯环上
F的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器为_______(填选项字母)
A.元素分析仪 B.红外光谱仪 C.质谱仪 D.核磁共振仪
(6)参照上述合成路线和信息,以乙醇和硝基苯为有机原料(无机试剂任选),设计制备![]() 的合成路线____________________。
的合成路线____________________。
【答案】 乙二醇(或1,2-乙二醇) 银氨溶液[或新制Cu(OH)2悬浊液] 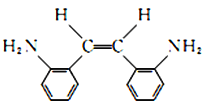 取代反应(或硝化反应) 加成反应
取代反应(或硝化反应) 加成反应  5 A
5 A 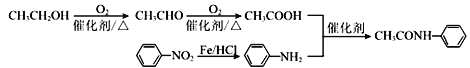
【解析】根据M的结构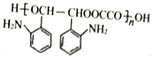 可知,M的单体为
可知,M的单体为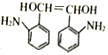 和HOOCCOOH,结合A的实验式为CH3O知A为乙二醇,B为乙二醛,C为乙二酸;D为甲苯,甲苯发生硝化反应生成E,结合H知,E为邻硝基甲苯,根据信息④,G为
和HOOCCOOH,结合A的实验式为CH3O知A为乙二醇,B为乙二醛,C为乙二酸;D为甲苯,甲苯发生硝化反应生成E,结合H知,E为邻硝基甲苯,根据信息④,G为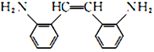 ,根据信息②和③,结合-NH2容易被氧化,则F为
,根据信息②和③,结合-NH2容易被氧化,则F为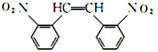 ,H与溴发生加成反应生成I,I水解生成J。
,H与溴发生加成反应生成I,I水解生成J。
(1)根据上述分析,A为乙二醇,B为乙二醛,可以用银氨溶液平[或新制Cu(OH)2悬浊液]检验B中的醛基,故答案为:乙二醇(或1,2-乙二醇) (2). 银氨溶液平[或新制Cu(OH)2悬浊液] ;
(2)G为 ,其顺式结构简式为
,其顺式结构简式为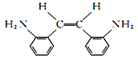 ,故答案为:
,故答案为: ;
;
(3)根据上述分析,D→E为硝化反应,H→I为加成反应,故答案为:取代反应(或硝化反应);加成反应;
(4)C+J→M的化学方程式为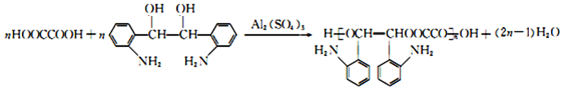 ,故答案为:
,故答案为: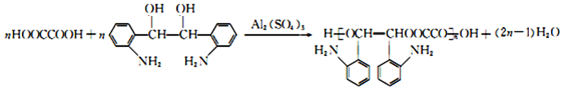 ;
;
(5)F为 ,同时满足:①含有
,同时满足:①含有![]() ;
;
②两个—NO2分别连在两个不同的苯环上,的F的同分异构体有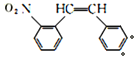 (●为另一个硝基可能的位置)2种;
(●为另一个硝基可能的位置)2种;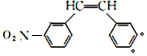 2种;
2种;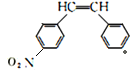 ,共5种,F的所有同分异构体含有相同的元素,在元素分析仪中显示的信号(或数据)完全相同故答案为:5;A;
,共5种,F的所有同分异构体含有相同的元素,在元素分析仪中显示的信号(或数据)完全相同故答案为:5;A;
(6)以乙醇和硝基苯为有机原料合成![]() 。可以先合成苯胺和乙酸,乙酸可以有乙醇合成,苯胺可以有硝基苯合成,合成路线为:
。可以先合成苯胺和乙酸,乙酸可以有乙醇合成,苯胺可以有硝基苯合成,合成路线为: ,故答案为:
,故答案为: 。
。


科目:高中化学 来源: 题型:
【题目】A 、B 、C 、D 、E是原子序数依次增加的短周期元素。
已知A是形成化合物种类最多的元素, B的第一电离能至第四电离能分别是932kJ·mol-1、1821kJ·mol-1、15390kJ·mol-1、21771kJ·mol-1;C元素原子核外最外层成对电子对数与其单电子数相等;D元素的常见单质的键能是双原子分子中最大的;E的氧化物是光电纤维的成分。F位于周期表中第四周期IIB族。回答下列问题:

(1)F元素原子的外围电子排布式____.在F元素的硫酸盐中逐滴滴入NaOH溶液至过量得到透明澄清的无色溶液,该溶液中含有一种带两个单位负电荷的配离子,则F元素的硫酸盐与过量NaOH溶液反应的化学方程式为_____
(2)B与氯元素形成的化合物的立体构型为_____
(3)C元素可形成多种单质。其中是一种单质的分子式为C60 则C60的为_____晶体,在该晶体中每个C原子只与相邻的3个C原子形成化学键,C60分子中只含有五边形和六边形。其结构如图1所示。则1molC60分子中含______molσ键
(4)A、C 、D三元素形成的一种分子,其化学式为 A6C3D6,该分子结构与苯相似,其结构中含有三个-DA2,则A6C3D6的结构简式为_____。该分子中电负性最大的元素的杂化轨道类型是_____
(5)C与 E两元素空间网状结构的晶体。其晶胞如图2所示。查阅资料可知该晶体的熔点低于金刚石,其理由是____,若该晶胞边长为a cm,碳原子直径为b cm,硅原子直径为c cm,则该晶胞的空间利用率为_______(用含a.b.c的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、镁、镍在工业生产和科研领域有广泛用途。请回答下列问题:
(1)基态碳原子中,能量最高的电子所占用的能级符号为_________;该能级中原子轨道的电子云形状为______________________。
(2)从石墨中可剥离出由单层碳原子构成的石墨烯,石墨烯中碳原子和共价键的数目之比为________。
(3)Mg2+能形成多种配合物和配离子,如Na4[Mg(PO3)4]、Mg[EDTA]2- EDTA的结构简式为( )等。
)等。
①PO3-的立体构型为____________,其中心原子的杂化轨道类型为__________,其中杂化轨道的作用为__________________________。
② 是常用的分析试剂。其中位于同周期的三种基态原子第一电离能由小到大的顺序为________________(用元素符号表示);这三种元素形成的一种离子与CS2互为等电子体,该离子符号为_____________。
是常用的分析试剂。其中位于同周期的三种基态原子第一电离能由小到大的顺序为________________(用元素符号表示);这三种元素形成的一种离子与CS2互为等电子体,该离子符号为_____________。
(4)晶体镁的堆积模型为____________;其中镁原子的配位数为______________。
(5)碳、镁、镍形成的某晶体的晶胞结构如图所示。若晶体密度为ρg·cm-1,阿伏伽德罗常数的值为NA,则晶胞参数a=___________pm(用代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产生活密切相关。下列说法错误的是
A. 臭氧、醋酸、双氧水都能杀菌消毒
B. 塑料的老化是因为其主要成分在空气中发生了缓慢的加成反应
C. “以火烧之,紫青烟起,乃真硝石(KNO3)",“紫青烟”是因为发生了焰色反应
D. 有人称“一带一路”是“现代丝绸之路”,丝绸的主要成分是蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(M分)研究碳、氮及其化合物的转化对于环境的改善有重大意义。氧化还原法消除NOx的转化如下:NO![]() NO2
NO2![]() N2
N2
已知:NO(g)+O3(g)==NO2(g)+O2(g) △H=-200.9kJ·mol-1
2NO(g)+O2(g)==2NO2(g) △H=-2116.2kJ·mol-1
(1)则反应I的热化学方程式为_________________。
(2)有人设想将CO按下列反应除去:2CO(g)==2C(s)+O2(g) △H >0,你认为该设想能否实现并说明理由:_____________________。
(3)一定条件下,CO可与粉末状的氢氧化钠作用生成甲酸钠。己知常温时,甲酸的电离平衡常数Ka= l.70×10-4。向20 mL 0.1 mol/L的甲酸钠溶液中滴加10mL 0.1 mol/L的盐酸,混合液呈_____(填“酸”或“碱”)性,溶液中离子浓度从大到小的顺序为_____________。
(4)活性炭也可用于处理汽车尾气中的NO。在2 L恒容密闭容器中加入0.1000 mol NO和2.030 mol固体活性炭,生成A、B两种气体,在不同温度下测得平衡体系中各物质的物质的量如下表:
固体活性炭/mol | NO/mol | A/mol | B/mol | |
200℃ | 2.000 | 0.040 0 | 0.030 0 | 0.030 0 |
335℃ | 2.005 | 0.050 0 | 0.025 0 | 0.025 0 |
①该反应的正反应为_________(填“吸热”或“放热”)反应。
②200℃时,平衡后向恒容容器中再充入0.100 0 mol NO,再次平衡后,NO的百分含量将__________(填“增大”“减小”或“不变”)。
③计算反应体系在335℃时的平衡常数_______________。
(5)CO2的处理方法有多种,将少量CO2气体通入石灰乳中充分反应,达到平衡后,测得溶液中c(OH-)=c mol/L,则c(CO32-)=_____ mol·L-1(用含a、b、c的代数式表示)。(已知Kap(CaCO3)=a,Kap[Ca(OH)2]=b)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 室温下,用pH试纸测定浓度为0.1 mol ·L-1 NaClO溶液的pH
B. 将4 mL 0.01mol ·L-1 KSCN溶液与1 mL 0.01 mol ·L-1 FeCl2溶液充分混合;再继续加入KSCN溶液,溶液颜色加深,证明溶液中存在平衡Fe3++ 3SCN-![]() Fe(SCN)3
Fe(SCN)3
C. 测定中和反应的反应热时,将碱的稀溶液缓慢倒入酸的稀溶液中,所测反应后混合液温度值偏小
D. 测定Na 2SO4溶液与Na2CO3溶液的酸碱性,说明非金属性:S>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列涉及有机物性质或应用的说法正确的是( )
A. 利用可降解的“玉米塑料”替代一次性饭盒,可减少“白色污染”
B. 乙烯、聚氯乙烯都能使溴水褪色
C. 保鲜膜、一次性食品袋的主要成分是聚氯乙烯
D. 人造纤维、合成纤维和光导纤维都是有机高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以证明乙酸是弱酸的事实是( )
A. 乙酸和水能任意比例混溶
B. 1molL﹣1的醋酸水溶液能使紫色石蕊试液变红色
C. 醋酸能与碳酸钠溶液反应生成CO2气体
D. 醋酸溶液中存在醋酸分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com