
| 序号 | 实验目的 | 方法及操作 |
| ① | 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 |
| ② | 证明SO2具有漂白性 | 将SO2通入酸性KMnO4溶液中 |
| ③ | 比较铜和镁的金属活动性强弱 | 用石墨作电极,电解同浓度的Mg(NO3)2、Cu(NO3)2的混合液 |
| ④ | 比较碳和硅两元素非金属性强弱 | 测同温、同浓度Na2CO3和Na2SiO3水溶液的pH |
| ⑤ | 判断不同反应的反应速率的大小 | 比较不同反应的反应热数据的大小 |
| A、①②④ | B、②③④ |
| C、①③④ | D、②③⑤ |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在c(HCO3-)=0.1mol/L的溶液中:NH4+、Al3+、Cl-、NO3- |
| B、在由水电离出的c(H+)=1×10-12mol/L的溶液中:Fe2+、ClO-、Na+、SO42- |
| C、在使红色石蕊试纸变蓝的溶液中:SO32-、CO32-、Na+、K+ |
| D、pH=1的溶液中:Mg2+、Fe3+、NO3-、[Ag(NH3)2]+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol/L的NaOH溶液:K+、AlO2-、SO42-、CO32- | ||
| B、0.1mol/LFeCl3溶液:K+、NH4+、I-、SCN- | ||
| C、0.1mol/L的Na2CO3溶液:K+、Ba2+、NO3-、Cl- | ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 在新能领域中,氢能已经普遍被认为是一种最理想的新世纪无污染的绿色能,21世纪将是氢能的世纪.电解尿素[CO(NH2)2]的碱性溶液制氢气的装置示意图如图(电解池中隔膜仅阻止气体通过,a、b极均为惰性电极).下列说法正确的是( )
在新能领域中,氢能已经普遍被认为是一种最理想的新世纪无污染的绿色能,21世纪将是氢能的世纪.电解尿素[CO(NH2)2]的碱性溶液制氢气的装置示意图如图(电解池中隔膜仅阻止气体通过,a、b极均为惰性电极).下列说法正确的是( )| A、电解时,b极是阴极放出H2,发生氧化反应 |
| B、溶液中OH-逐渐向b极移动 |
| C、电解时,a极的电极反应式为:CO(NH2)2+8OH-6e-═CO32-+N2↑+6H2O |
| D、若在b极产生标准状况下224mL H2,则消耗尿素2g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol?L-1 CH3COONa溶液中:c(OH-)>c(CH3COOH)+c(H+) |
| B、0.1mol?L-1的NH4Cl溶液与0.05mol?L-1的NaOH溶液等体积混合后溶液显碱性:c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+) |
| C、酸式盐NaHB在水溶液中,HB-的电离程度小于HB-的水解程度,则:c(Na+)>c(HB-)>c(OH-)>c(B2-)>c(H+) |
| D、1.0L 0.3mol?L-1 NaOH溶液缓慢通入CO2气体至溶液增重8.8g,所得溶液中:c(Na+)=c(HCO3-)+2c(CO32-)+c(OH-)-c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯酚钠溶液中通入CO2气体后产生白色沉淀,通过抽滤可分离出苯酚 |
| B、滴定实验时,锥形瓶用蒸馏水洗净后,直接盛待测液 |
| C、基于硫代硫酸钠与稀硫酸反应生成S和SO2,在定量测定反应速率时,既可用S对标记遮盖法,也可用排水法测SO2体积,计算出其的反应速率 |
| D、某溶液加入盐酸酸化的BaCl2溶液,若有白色沉淀生成,则原溶液含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol?L-1 CH3COONa溶液中:c(CH3COO-)+c(CH3COOH)=0.1mol?L-1 |
| B、浓度均为0.1 mol?L-1 Na2CO3溶液和稀盐酸等体积混合后的溶液中:c(CO32-)+c(OH-)=c(H+)+c(H2CO3) |
| C、25℃时,pH=9.4、浓度均为0.1 mol?L-1的HCN与NaCN的混合溶液中:c(Na+)>c(CN-)>c(HCN)>c(OH-) |
| D、3.0L 0.1mol?L-1 NaOH溶液中缓慢通入CO2至溶液增重8.8 g时,溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
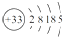 .
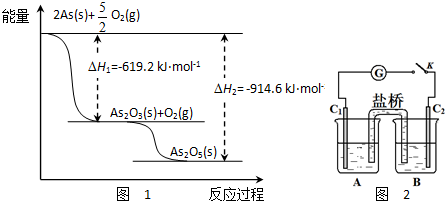
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com