
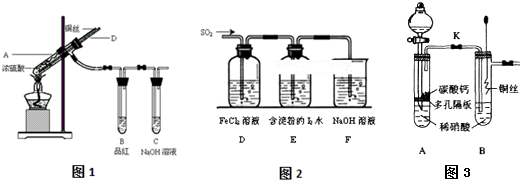
分析 (1)盐酸不能与金属铜反应,但可以与氧化铜反应,所以双氧水的作用是将金属铜氧化为CuO,然后氧化铜溶于盐酸;
(2)①铜与浓硫酸加热反应生成二氧化硫气体,二氧化硫具有漂白性,能够使品红溶液褪色;
②可以从D导管通入空气,将装置中二氧化硫完全排出;
③根据装置连接顺序、二氧化硫的化学性质、铁离子的检验方法等知识进行分析解答;
(3)①装置中氧气能够与一氧化氮反应,需要用二氧化氮排出装置中空气;一氧化氮为有毒气体,需要使用尾气吸收装置,不能直接排放到空气中;
②过量铜粉与一定量浓硝酸反应,反应开始是生成NO2:Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O;随着反应的进行,硝酸浓度降低,稀硝酸与铜反应生成NO:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,据此判断硝酸的物质的量范围.
解答 解:(1)盐酸不能与金属铜反应,但可以与氧化铜反应,所以双氧水的作用是将金属铜氧化为CuO,然后氧化铜溶于盐酸,反应的离子方程式为Cu+H2O2+2H+=Cu2++2H2O,
故答案为:Cu+H2O2+2H+=Cu2++2H2O;
(2)①图1中铜与浓硫酸反应生成硫酸铜、二氧化硫和水:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+H2O,二氧化硫具有漂白性,所以试管B中品红溶液颜色变浅或褪色,
故答案为:品红溶液颜色变浅或褪色;
②拆除装置前,不需打开胶塞,就可使装置中残留气体完全被吸收,采取的操作方法为:从D管口向A中大量鼓气,将装置中二氧化硫气体完全排出,
故答案为:从D管口向A中大量鼓气;
③a.碘离子还原性小于二氧化硫,所以能表明I-的还原性小于SO2的现象是E中蓝色溶液褪色,故a错误;
b.二氧化硫有毒,氢氧化钠溶液能够与二氧化硫反应,所以装置F的作用是吸收SO2尾气,防止污染空气,故b正确;
c.二氧化硫被铁离子氧化生成硫酸根离子,加入用稀盐酸酸化的BaCl2,产生白色沉淀,该白色沉淀一定为硫酸钡,则证明D中发生了氧化还原反应,故c正确;
d.D中FeCl3完全发生了氧化还原反应,则溶液中不存在铁离子,加入KSCN溶液,混合液无明显现象,故d正确;
故答案为:a;
(3)①空气中氧气能够与一氧化氮气体反应生成二氧化氮,需要将装置中空气排出,所以装置A的目的是利用产生的二氧化碳气体排出B管中的氧气;NO有毒,装置中必须使用尾气吸收装置,否则会组成环境污染,
故答案为:利用产生的二氧化碳气体排出B管中的氧气;无尾气吸收装置;
②过量铜粉与一定量浓硝酸反应,反应开始是生成NO2,反应方程式为:Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O;随着反应的进行,硝酸浓度降低,稀硝酸与铜反应生成NO,发生反应的方程式为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;
生成气体的物质的量为:$\frac{1.12L}{22.4L/mol}$=0.05mol,当生成气体全部为NO2时,消耗的硝酸的物质的量为:0.05mol×2=0.10mol,当生成气体全部为NO时,消耗的硝酸的物质的量为:0.05mol×4=0.20mol,所以消耗的硝酸的物质的量介于0.10mol和0.20mol之间,只有B符合,
故答案为:NO2、NO;B.
点评 本题通过三大强酸的性质,考查了性质实验方案的设计方法,题目难度中等,注意掌握化学实验基本操作方法,明确性质实验方案设计的原则,试题侧重考查学生的分析、理解能力及化学实验能力.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:选择题
| A. | 增加CO的浓度 | B. | 加压 | C. | 分离出硫 | D. | 加催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ② | C. | ③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 37.6% | B. | 36.8% | C. | 25.6% | D. | 51.2% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com