
【题目】I.已知:
①2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
②H2O(l)= H2O(g) △H=+44kJ/mol
③C(s)+ ![]() O2(g)=CO(g) △H=-110.5kJ/mol
O2(g)=CO(g) △H=-110.5kJ/mol
④C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol
回答下列问题:
(1)上述变化中吸热的是___________。
(2)C的燃烧热△H=___________。
(3)燃烧2gH2生成液态水,放出的热量为___________。
(4)写出CO燃烧的热化学方程式___________。
Ⅱ.在一定条件下,xA+yB![]() zC可逆反应达到平衡,试填出:
zC可逆反应达到平衡,试填出:
(1)若A、B、C都是气体,在减压后平衡向逆反应方向移动,则x、y、z的关系是_______。
(2)若C是气体,并且x+y=z,在加压时化学平衡如发生移动必定向_______。(填正或逆)反应方向移动。
(3)当改变某种反应条件后,正反应速率增大,而气体A和气体B的浓度均未变,则改变的条件可能是_______。
【答案】 ② ΔH = - 393.5 kJ/mol 285.8 kJ CO(g) + 1/2 O2 (g)= CO2(g) ΔH = - 283 kJ/mol x + y > z 逆 加催化剂
【解析】I.(1)焓变为正值的反应是吸热反应,上述变化中吸热的是H2O(l)= H2O(g) △H=+44kJ/mol,故选②;(2)1molC完全燃烧生成CO2,由C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol,C的燃烧热△H= - 393.5 kJ/mol ;(3)由①2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol②H2O(l)= H2O(g) △H=+44kJ/mol,将①-2②得2H2(g)+O2(g)=2H2O(l
) △H=-571.6kJ/mol,燃烧2gH2生成液态水,放出的热量为![]() =285.8 kJ;(4)③C(s)+
=285.8 kJ;(4)③C(s)+ ![]() O2(g)=CO(g) △H=-110.5kJ/mol,④C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol,④-③得CO燃烧的热化学方程式: CO(g) + 1/2 O2 (g)= CO2(g) ΔH = - 283 kJ/mol ;
O2(g)=CO(g) △H=-110.5kJ/mol,④C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol,④-③得CO燃烧的热化学方程式: CO(g) + 1/2 O2 (g)= CO2(g) ΔH = - 283 kJ/mol ;
Ⅱ.(1)若A、B、C都是气体,在减压后平衡向逆反应方向移动,减小压强平衡向气体体积增大的方向进行,则x、y、z的关系是x + y > z;(2)C是气体,且x+y=z,在加压时化学平衡可发生移动,说明X、Y至少有1种不是气体,逆反应是气体体积减小的反应,故平衡向逆反应方向移动;(3)当改变某种反应条件后,正反应速率增大,而气体A和气体B的浓度均未变,则改变的条件可能是使用催化剂,改变速率,平衡不移动。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列有关说法正确的是( )
A.1mol甲基(-CH3)所含的电子总数为8NA
B.0.5mol苯分子中含有C=C双键数为1.5NA
C.11.2L甲醛所含分子数为0.5NA
D.14g乙烯、丙烯的混合气体所含原子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将m g含氧化铁、氧化铜或氧化亚铁的样品投入到2L物质的量浓度为1mol/L的盐酸中恰好完全反应,若向等质量的该样品中通入足量的氢气并加热,充分反应后所得金属的质量是( )
A.(m﹣16)g
B.(m+16)g
C.(m﹣32)g
D.16g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中溶质的物质的量浓度为1mol/L的是( )
A.将40gNaOH溶解在1L水中
B.将1L10mol/L的浓盐酸加入9L水中
C.将22.4LHCl气体溶于水配成1L溶液
D.将10gNaOH溶解在少量水中,再加蒸馏水直到溶液体积为250mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,两瓶体积相等的气体,在同温同压时瓶内气体(N2O和CO2不发生化学反应)的关系不一定正确的是( ) 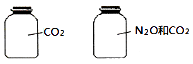
A.所含氧原子数相等
B.气体的总质量相等
C.气体所含电子总数相等
D.气体的密度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将淀粉和淀粉酶的混合物放入玻璃纸袋中,扎好袋口,浸入流动的温水中,完全反应后,取袋内液体分别与碘水、新制Cu(OH)2(加热)和浓硝酸(微热)作用,其现象分别是
A. 显蓝色、无现象、显黄色 B. 显蓝色、红色沉淀、无现象
C. 无现象、红色沉淀、无现象 D. 无现象、变黑色、显黄色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置.请回答:
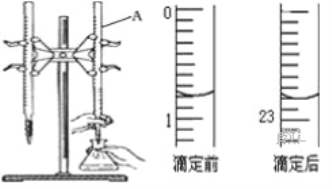
(1)仪器A的名称是__________________;
(2)盐酸滴定管中滴定后读数为_____________mL;
(3)某实验小组同学的三次实验的实验数据如下表所示.根据表中数据计算出的待测NaOH溶液的浓度是________________;(保留四位有效数字)
实验 编号 | 待测NaOH溶液的体积(mL) | 滴定前盐酸的 体积读数(mL) | 滴定后盐酸的 体积读数(mL) |
1 | 20.00 | 1.20 | 23.22 |
2 | 20.00 | 2.21 | 24.21 |
3 | 20.00 | 1.50 | 23.48 |
(4)滴定操作可分解为如下几步(所用的仪器刚用蒸馏水洗净):
A.用碱式滴定管向锥形瓶里注入20.00mL待测NaOH溶液,并加入2~3滴酚酞;
B.用标准溶液润洗酸式滴定管2~3次;
C.把盛有标准溶液的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液,使管内无气泡;
D.取标准盐酸注入酸式滴定管至刻度0以上2~3cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准盐酸滴定至终点并记下滴定管液面的刻度。
正确操作步骤的顺序是(用序号字母填写)_____________;
(5)判断到达滴定终点的实验现象是________________________________;
(6)滴定操作时,如果上述B步骤省略,对测定结果的影响是_____(填“无影响”、“偏高”或“偏低”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com