
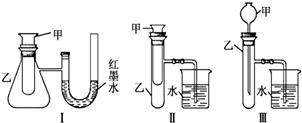
分析 (1)酸碱中和反应为放热反应,反应放出的热使锥形瓶中温度升高,气体体积增大,据此判断U型管中液面的变化;
(2)钠与水的反应为放热反应,温度升高导致大试管中气体受热压强增大,烧杯中有气泡产生,冷却后体积减小,压强减小,导管中会形成水柱;M溶于水放出热量,不一定为化学变化,则不一定属于放热反应;
(3)铵盐和碱反应生成氨气,Ba(OH)2•8H2O与NH4Cl的反应生成氨气、水、以及氯化钡,该反应吸热,溶液的温度降低,烧杯里的导管内形成一段液柱.
解答 解:(1)氢氧化钡与硫酸反应属于中和反应,中和反应都是放热反应,所以锥形瓶中气体受热膨胀,导致U型管左端液柱降低,右端液柱升高,
故答案为:左端液柱降低,右端液柱升高;放热;
(2)①若M为钠,钠与水反应生成氢氧化钠和氢气,该反应为放热反应,放热的热量使大试管中温度升高,气体压强增大,所以右边烧杯中有气泡产生;冷却后大试管中温度降低,压强减小,右边烧杯中的导管会形成一端液柱,
故答案为:产生气泡,反应完毕后,冷却至室温,烧杯里的导管内形成一段液柱;
②若观察到烧杯里产生气泡,说明M溶于水放出热量,由于放热反应一定属于化学变化,而有热量放出的反应不一定为化学变化,所以不一定属于放热反应,某些物质(如氢氧化钠、浓硫酸)溶于水放热,但不是化学反应,
故答案为:可能是放热反应;某些物质(如氢氧化钠)溶于水放热,但不是化学反应;
(3)氯化铵属于铵盐,若固体M为Ba(OH)2•8H2O与NH4Cl的混合物,经不断搅拌后,NH4Cl能和强碱氢氧化钡反应生成氨气、水、以及氯化钡,化学方程式为Ba(OH)2•8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O,Ba(OH)2•8H2O与NH4Cl的反应是吸热反应,吸热使锥形瓶内空气遇冷收缩致使压强减小,烧杯里的导管内形成一段液柱,
故答案为:烧杯里的导管内形成一段液柱;Ba(OH)2•8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O.
点评 本题考查化学反应中的热效应,题目难度中等,注意掌握探究反应热效应的常用方法,试题有利于培养学生实验综合分析能力,特别是实验的评价和根据实验现象推理的能力.


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:选择题
 \如图所示的甲、乙、丙三种物质均含有相同的某种元素,箭头表示物质间的转化一步就能实现,则甲可能是( )
\如图所示的甲、乙、丙三种物质均含有相同的某种元素,箭头表示物质间的转化一步就能实现,则甲可能是( )| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、H2S、Cl2 | B. | SO2、O2、NH3 | C. | NO、O2、H2 | D. | SO2、CO2、O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 C、Be、Cl、Fe等元素及其化合物有重要的应用.
C、Be、Cl、Fe等元素及其化合物有重要的应用.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲醛、甲酸、甲酸甲酯和乙醇都能使酸性高锰酸钾溶液褪色 | |
| B. | 相同条件,等物质的量的乙醇、乙二醇、丙三醇中分别加入足量的金属钠产生氢气的体积之比是2:3:6 | |
| C. | 苯酚和乙醛都可以使溴水褪色,但发生的反应类型不同 | |
| D. | 溴水既可鉴别乙烷与乙烯,又可除去乙烷中的乙烯而得到纯净的乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ |
 ;由H和①形成的原子数之比为1:1的物质
;由H和①形成的原子数之比为1:1的物质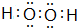 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象与结论(或装置用途) |
| A | 某溶液加入浓NaOH溶液加热,在试管口放一片湿润的红色石蕊试纸 | 试纸变蓝,说明NH3是碱 |
| B | 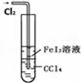 | 可以用于比较Fe3+、I2、Cl2的氧化性强弱 |
| C | 2mL 2% CuSO4中加4~6滴2% NaOH溶液,振荡后加入0.5mL X溶液,加热煮沸 | 未出现砖红色沉淀,说明X不含有醛基 |
| D | 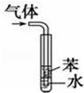 | 用于吸收HCl气体能防倒吸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.若用如图实验装置可制得纯净的Fe(OH)2沉淀,两极材料分别为石墨和铁.
Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.若用如图实验装置可制得纯净的Fe(OH)2沉淀,两极材料分别为石墨和铁.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com