
【题目】人体血液存在![]() 、
、![]() 等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值
等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值![]() 表示
表示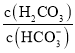 或
或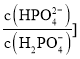 与pH的关系如图所示。已知碳酸
与pH的关系如图所示。已知碳酸![]() 、磷酸
、磷酸![]()
![]() 。则下列说法不正确的是( )
。则下列说法不正确的是( )
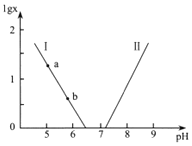
A.曲线Ⅱ表示 与pH的变化关系
与pH的变化关系
B.![]() 的过程中,水的电离程度逐渐增大
的过程中,水的电离程度逐渐增大
C.当![]()
![]() 时,
时,![]()
D.当pH增大时,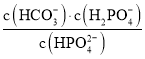 逐渐增大
逐渐增大
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】室温下,向![]() 溶液中逐滴加入
溶液中逐滴加入![]() 盐酸,溶液含R微粒的物质的量分数与pH关系如图所示
盐酸,溶液含R微粒的物质的量分数与pH关系如图所示![]() 不稳定,易转化为
不稳定,易转化为![]() 气体逸出溶液,气体逸出未画出,忽略因气体逸出引起的溶液体积变化
气体逸出溶液,气体逸出未画出,忽略因气体逸出引起的溶液体积变化![]() 下列说法错误的是
下列说法错误的是![]()
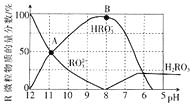
A.![]() 溶液中:
溶液中:![]()
B.当溶液![]() 时,溶液总体积大于40mL
时,溶液总体积大于40mL
C.在B点对应的溶液中,离子浓度最大的是![]()
D.A点对应pH约为![]() ,
,![]() 的水解常数
的水解常数![]() 数量级为
数量级为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤和石油是化工原料的重要来源,从石油中获得A,是工业上生产A的主要途径,A可用作植物生长调节剂。从煤焦油中可获得烃B,B中碳、氢两种元素的质量比为12:1,且B是常见的有机溶剂。工业上可以通过以下途径获得A、B。
![]()
![]()
(1)由煤得到煤焦油的方法称为________;由石蜡油获得A的方法称为________。
(2)A和B中,能使酸性高锰酸钾溶液褪色的是________(填“A”或“B”)。
(3)写出B发生取代反应的化学方程式:________________________(写一个即可,并注明反应条件)。
(4)用B和丙烯可以生产两种重要的化工原料:苯酚(![]() )和丙酮(
)和丙酮(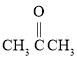 ),生产流程如下:
),生产流程如下:
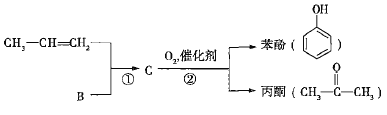
已知反应①是加成反应,C的一氯代物有5种,则C的结构简式为_____________;反应②的化学方程式为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于![]() 说法正确的是( )
说法正确的是( )
A.同一条直线上碳原子有6个
B.所有原子可能在同一平面上
C.同一平面上的原子最多有19个
D.所有碳原子不可能在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,水的电离达到平衡:H2O![]() H++OH-△H>0,下列叙述正确的是( )
H++OH-△H>0,下列叙述正确的是( )
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体亚硫酸氢钠,c(H+)增大,水的电离程度增大
C.由水电离出的c(H+)=1×10-12mol/L的溶液pH一定为12
D.将水加热,Kw增大,pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,现有![]() 的
的![]() 溶液,
溶液,![]() 已知含氮
已知含氮![]() 或含碳
或含碳![]() 各微粒的分布分数
各微粒的分布分数![]() 平衡时某种微粒的浓度占各种微粒浓度之和的分数
平衡时某种微粒的浓度占各种微粒浓度之和的分数![]() 与pH的关系如图所示。下列说法不正确的是
与pH的关系如图所示。下列说法不正确的是![]()
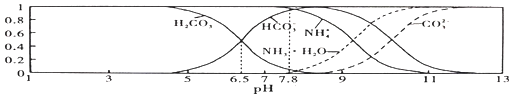
A.常温下![]()
B.向![]() 的上述溶液中逐滴滴加NaOH溶液时,
的上述溶液中逐滴滴加NaOH溶液时,![]() 和
和![]() 浓度都逐渐减小
浓度都逐渐减小
C.![]() 溶液中存在下列守恒关系:
溶液中存在下列守恒关系:![]()
D.当溶液的![]() 时,溶液中存在下列关系:
时,溶液中存在下列关系:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质在适宜的条件下反应,其中氧化剂与还原剂的物质的量之比为2:1的是( )
A. ![]()
B. Fe2O3+2Al![]() Al2O3+2Fe
Al2O3+2Fe
C. CaH2+2H2O===Ca(OH)2+2H2↑
D. 3NO2+H2O===2HNO3+NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向20.00mL0.1mol·L-1H2X溶液中滴入0.1mol·L-1 NaOH溶液,溶液中由水电离出的c水(OH-)的负对数[-1gc水(OH-)]与所加NaOH溶液体积的关系如图所示。

下列说法中正确的是
A. 水的电离程度:M>N=Q>P
B. 图中M、P、Q三点对应溶液中![]() 相等
相等
C. N点溶液中c(Na+)>c(X2-)>c(HX-)>c(H+)=c(OH-)
D. P点溶液中c(OH-)=c(H+)+c(HX-)+c(H2X)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能被视为21世纪最具发展潜力的清洁能源。
(1)水是制取H2的常见原料,下列有关水的说法正确的是______.
a.水分子是一种极性分子,水分子空间结构呈直线型
b.1个H2O分子中有2个由s轨道与sp3杂化轨道形成的σ键
c.水分子间通过H﹣O键形成冰晶体
d.冰晶胞中水分子的空间排列方式与干冰晶胞类似
(2)氢气的安全贮存和运输是氢能应用的关键。
①最近尼赫鲁先进科学研究中心借助ADF软件对一种新型环烯类储氢材料(C16S8)进行研究,从理论角度证明这种分子中的原子都处于同一平面上(如图1所示),每个平面上下两侧最多可存10个H2分子.分子中C原子的杂化轨道类型为______,C16S8中σ键与π键之比为______,C16S8与H2微粒间的作用力是______。
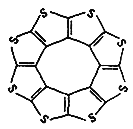
②氨硼烷化合物(NH3BH3)是最近密切关注的一种新型化学氢化物储氢材料.请画出含有配位键(用“→”表示)的氨硼烷的结构式_____;与氨硼烷互为等电子体的有机小分子是___(写结构简式)。
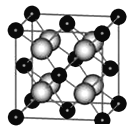
③某种具有储氢功能的铜合金晶体具有立方最密堆积的结构,晶胞中Cu原子处于面心,Au原子处于顶点位置,氢原子可进人到由Cu原子与Au原子构成的四面体空隙中.若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2(晶胞结构如图)的结构相似,该晶体储氢后Cu:Au:H为______。
④MgH2是金属氢化物储氢材料,其晶胞如图所示,已知该晶体的密度ag·cm-3,则晶胞的体积为______________cm3(用含a、NA的代数式表示,NA表示阿伏伽德罗常数)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com