
【题目】某温度下,将2molA和3molB充入一密闭的容器中发生反应:aA(g)+B(g)![]() C(g)+D(g),5 min后达平衡。已知该反应在此温度下平衡常数K=1,若温度不变的情况下将容器的体积扩大为原来的10倍,A的转化率不发生变化,则
C(g)+D(g),5 min后达平衡。已知该反应在此温度下平衡常数K=1,若温度不变的情况下将容器的体积扩大为原来的10倍,A的转化率不发生变化,则
A. a="3" B. a="2" C. B的转化率为40% D. B的转化率为60%
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. PM2.5是指空气中氮氧化物和硫氧化物含量之和
B. 鸡蛋清溶液中滴加醋酸铅溶液会发生盐析
C. 使用无铅汽油的汽车尾气不会污染空气
D. 水体中植物营养物质过多积累会引起水体富营养化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列做法不正确的是
A. 为了使豆腐白嫩和富有弹性,制作时可使用吊白块(具有漂白性)和烧碱
B. 金属Mg失火时不能用泡沫灭火器扑灭
C. 土壤胶粒带负电荷,有利于铵态氮肥的吸收
D. 水玻璃可用于生产黏合剂和防火剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是
A.0.2 mol NaOH含有0.2NA个NaOH分子
B.3.2 g O2和O3的混合气体中氧原子数为0.25NA
C.常温下,1 mol Cl2与过量NaOH溶液反应,转移电子总数为NA
D.过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3在现代工业生产中应用广泛。经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。工业上,向500—600℃的铁屑中通入氯气可生产无水氯化铁;向炽热铁屑中通入氯化氢可以生产无水氯化亚铁。
某化学研究性学习小组模拟工业生产流程制备无水FeCl3并对产物做了如下探究实验,请回答下列问题:
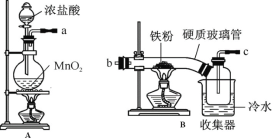
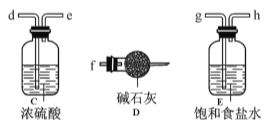
(1)装置的连接顺序为 (用a 、b、c…h表示)。
(2)i.A装置中反应的化学方程式为 。
ii.D中碱石灰的作用是 。
(3)反应结束后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管B中硬质玻璃管的右端。要使沉积得FeCl3进入收集器,需进行的操作是 。
(4)FeCl3溶液常用于吸收有毒气体H2S。反应的离子方程式为 。
(5)反应一段时间后熄灭酒精灯,冷却后将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(过程中不振荡),充分反应后,进行如下实验:

淡黄色溶液中加入试剂X生成淡红色溶液的离子方程式为 。
(6)已知红色褪去的同时有气体生成,经检验为O2。该小组同学对红色褪去的原因进行探究。
①取褪色后溶液三份,第一份滴加FeCl3溶液无明显变化;第二份滴加试剂X,溶液出现红色;第三份滴加稀盐酸和BaCl2溶液,产生白色沉淀。
②另取同物质的量浓度的 FeCl3溶液滴加2滴试剂X,溶液变红,再通入O2,无明显变化。
根据上述实验得出溶液褪色的原因是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂。其一种生产工艺原理如下:
①2NaClO3+SO2+H2SO4==2ClO2+2NaHSO4
②2ClO2+NaCl![]() 2NaClO2+Cl2
2NaClO2+Cl2
回答下列问题:
(1)NaClO2中的Cl 的化合价__________。
(2)将反应①改为离子反应方程式_______________________。
(3)标出反应②的电子转移的方向和数目_________________________。
(4)用于电解的食盐水需先除去其中Ca2+、Mg2+、SO42-等杂质,除杂操作时,依次加入的试剂顺序为NaOH、_________、_________充分反应后,将沉淀一并过滤除去。
(5)电解产生的尾气中有少量ClO2,(二氧化氯具有强氧化性)可以用H2O2碱性溶液吸收除去,该反应中的氧化产物为_________。
(6)KClO2和Cl2均能将电镀废水中CN- 氧化为无毒的物质,自身被还原为Cl-。处理含CN- 相同量电镀废水所需Cl2的物质的量是KClO2__________倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据所学知识回答下列问题:
(1)同温同压下,反应H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH(化学计量数相同)分别为ΔH1、ΔH2,ΔH1____________ΔH2(填“>”“<”或“=”下同)。
(2)相同条件下,2 mol氢原子所具有的能量____________1 mol 氢分子所具有的能量。
(3)已知:常温下,0.01 mol·L-1 MOH溶液的pH为10,MOH(aq)与H2SO4(aq)反应生成1 mol可溶正盐的ΔH=-24.2 kJ·mol-1,强酸与强碱的稀溶液的中和热为ΔH=-57.3 kJ·mol-1。则MOH在水溶液中电离的ΔH为_______________
(4)土壤中的微生物可将大气中H2S经两步反应氧化成SO42-,两步反应的能量变化示意图如下:
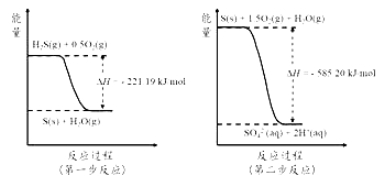
1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式为______________________。
(5)一定条件,在水溶液中1 mol Cl-、ClO x-(x=1,2,3,4)的能量(KJ)相对大小如图所示。
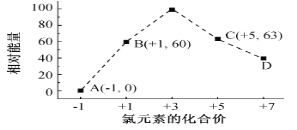
①D是______________________ (填离子符号)。
②B→A+C反应的热化学方程式为______________________ (用离子符号表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com