½ā“š£ŗ½ā£ŗ£Ø1£©ČōAŹĒĮņ»Ē£¬BŹĒĘųĢ¬Ēā»ÆĪļ£¬Ó¦ĪŖH
2S£¬CŹĒŌģ³ÉĖįÓźµÄĪŪČ¾ĪļÖ®Ņ»£¬Ó¦ĪŖSO
2£¬¢Ü·“Ó¦ŹĒĶØŅ»ÖÖ»ĘĀĢÉ«ĘųĢ壬ӦĪŖC1
2£¬Éś³ÉDŗĶĮķŅ»ÖÖ²śĪļE£¬DŹĒŅ»ÖÖŗ¬ŃõĖį£¬Ó¦ĪŖH
2SO
4£¬EĪŖHCl£¬·“Ó¦¢ÜµÄ·½³ĢŹ½ĪŖC1
2+SO
2+2H
2O=H
2SO
4+2HCl£¬¼ģŃéĀČĄė×Ó£¬æÉÓĆAgNO
3ČÜŅŗ£¬Ļ”HNO
3£¬æɲśÉś²»ČÜÓŚĻõĖįµÄAgCl°×É«³Įµķ£¬
¹Ź“š°øĪŖ£ŗC1
2+SO
2+2H
2O=H
2SO
4+2HCl£»AgNO
3ČÜŅŗ£¬Ļ”HNO
3£»
£Ø2£©ČōDĪļÖŹ¾ßÓŠĮ½ŠŌĶʶĻDĪŖAl£ØOH£©
3£¬¢Ü·“Ó¦ŹĒĶØČė¹żĮæµÄŅ»ÖÖŅżĘšĪĀŹŅŠ§Ó¦µÄÖ÷ŅŖĘųĢ壬ĖµĆ÷CĪŖĘ«ĀĮĖįÄĘNaAlO
2£¬¢Ś¢Ū·“Ó¦¾łŅŖÓĆĒæ¼īČÜŅŗ£¬ÅŠ¶ĻAĪŖAl£¬BĪŖAlCl
3£¬·“Ó¦¢ÜĄė×Ó·½³ĢŹ½£ŗAlO
2-+2H
2O+CO
2ØTAl£ØOH£©
3”ż+HCO
3-£¬ĄūÓĆAµÄ»¹ŌŠŌŗĶA×Ŗ»ÆĪŖŃõ»ÆĪļŹ±Äܷųö“óĮæČȵĊŌÖŹ£¬¹¤ŅµÉĻ³£ÓĆAĄ“»¹ŌŅ»Š©½šŹōŃõ»ÆĪļ£¬ĪŖĀĮČČ·“Ó¦£¬Čē2Al+Fe
2O
32Fe+Al
2O
3£¬
¹Ź“š°øĪŖ£ŗAlO
2-+2H
2O+CO
2ØTAl£ØOH£©
3”ż+HCO
3-£»2Al+Fe
2O
32Fe+Al
2O
3£»
£Ø3£©ČōAŹĒÓ¦ÓĆ×ī¹ć·ŗµÄ½šŹō£®ĶʶĻĪŖFe£¬¢Ü·“Ó¦ÓƵ½A£¬¢Ś¢Ż·“Ó¦¾łÓƵ½Ķ¬Ņ»ÖÖ·Ē½šŹōµ„ÖŹ£®ĶʶĻĪŖCl
2£¬CµÄČÜŅŗÓĆÓŚŹ“æĢÓ”Ė¢ĶµēĀ·°å£¬ÅŠ¶ĻCĪŖFeCl
3£¬DĪŖFeCl
2£¬øĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗCu+2Fe
3+=Cu
2++2Fe
2+£¬
¹Ź“š°øĪŖ£ŗCu+2Fe
3+=Cu
2++2Fe
2+£®

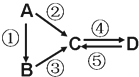 A”¢B”¢C”¢D¾łĪŖ֊ѧ»Æѧ³£¼ūµÄ“æ¾»Īļ£¬AŹĒµ„ÖŹ£®ĖüĆĒÖ®¼äÓŠČēĻĀµÄ·“Ó¦¹ŲĻµ£ŗ
A”¢B”¢C”¢D¾łĪŖ֊ѧ»Æѧ³£¼ūµÄ“æ¾»Īļ£¬AŹĒµ„ÖŹ£®ĖüĆĒÖ®¼äÓŠČēĻĀµÄ·“Ó¦¹ŲĻµ£ŗ


 A”¢B”¢C”¢D¾łĪŖ³£¼ūĪļÖŹ£¬Ļą»„Ö®¼äµÄ¹ŲĻµČēĶ¼ĖłŹ¾£®”°-”±±ķŹ¾Į½ÖÖĪļÖŹ¼äÄÜ·¢Éś·“Ó¦£¬”°”ś”±±ķŹ¾ĪļÖŹ¼äµÄ×Ŗ»Æ¹ŲĻµ£¬²æ·Ö·“Ó¦Īļ»ņÉś³ÉĪļŅŌ¼°·“Ó¦Ģõ¼žŅŃĀŌČ„£©£®
A”¢B”¢C”¢D¾łĪŖ³£¼ūĪļÖŹ£¬Ļą»„Ö®¼äµÄ¹ŲĻµČēĶ¼ĖłŹ¾£®”°-”±±ķŹ¾Į½ÖÖĪļÖŹ¼äÄÜ·¢Éś·“Ó¦£¬”°”ś”±±ķŹ¾ĪļÖŹ¼äµÄ×Ŗ»Æ¹ŲĻµ£¬²æ·Ö·“Ó¦Īļ»ņÉś³ÉĪļŅŌ¼°·“Ó¦Ģõ¼žŅŃĀŌČ„£©£®

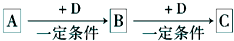 A”¢B”¢C”¢D¾łĪŖ֊ѧ»Æѧ֊³£¼ūµÄĪļÖŹ£¬ĖüĆĒÖ®¼äµÄ×Ŗ»Æ¹ŲĻµČēĻĀĶ¼£Ø²æ·Ö²śĪļŅŃĀŌČ„£©£ŗŹŌ»Ų“š£ŗ
A”¢B”¢C”¢D¾łĪŖ֊ѧ»Æѧ֊³£¼ūµÄĪļÖŹ£¬ĖüĆĒÖ®¼äµÄ×Ŗ»Æ¹ŲĻµČēĻĀĶ¼£Ø²æ·Ö²śĪļŅŃĀŌČ„£©£ŗŹŌ»Ų“š£ŗ

 A”¢B”¢C”¢D¾łĪŖ¶ĢÖÜĘŚŌŖĖŲ£¬AŗĶBŹĒĶ¬ÖÜĘŚĻąĮŚµÄĮ½ÖÖŌŖĖŲ£¬AŗĶCŹĒĶ¬Ö÷×åĻąĮŚµÄĮ½ÖÖŌŖĖŲ£ŗA”¢B”¢CČżÖÖŌŖĖŲµÄŌ×ÓŠņŹżÖ®ŗĶĪŖ31£»DŌŖĖŲÓėA”¢B”¢CČżÖÖŌŖĖŲ¼Č²»ŹĒĶ¬ÖÜĘŚ£¬Ņ²²»Ķ¬Ö÷×壮Ēė»Ų“š£ŗ
A”¢B”¢C”¢D¾łĪŖ¶ĢÖÜĘŚŌŖĖŲ£¬AŗĶBŹĒĶ¬ÖÜĘŚĻąĮŚµÄĮ½ÖÖŌŖĖŲ£¬AŗĶCŹĒĶ¬Ö÷×åĻąĮŚµÄĮ½ÖÖŌŖĖŲ£ŗA”¢B”¢CČżÖÖŌŖĖŲµÄŌ×ÓŠņŹżÖ®ŗĶĪŖ31£»DŌŖĖŲÓėA”¢B”¢CČżÖÖŌŖĖŲ¼Č²»ŹĒĶ¬ÖÜĘŚ£¬Ņ²²»Ķ¬Ö÷×壮Ēė»Ų“š£ŗ

 NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+ 2NH3
2NH3 2NH3
2NH3

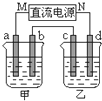 ČēĶ¼ĖłŹ¾µÄ×°ÖĆÖŠ£¬¼×”¢ŅŅĮ½ÉÕ±ÖŠ·Ö±šŹ¢·ÅÓŠ×ćĮæµÄCuSO4ČÜŅŗŗĶ100g 10.00%µÄK2SO4ČÜŅŗ£¬a”¢b”¢c”¢d¾łĪŖŹÆÄ«µē¼«£®½ÓĶصēŌ“Ņ»¶ĪŹ±¼äŗ󣬲āµĆŅŅÖŠK2SO4ČÜŅŗÅضČĪŖ10.47%£¬¼×ÖŠaµē¼«µÄÖŹĮæŌö¼Ó£®ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©
ČēĶ¼ĖłŹ¾µÄ×°ÖĆÖŠ£¬¼×”¢ŅŅĮ½ÉÕ±ÖŠ·Ö±šŹ¢·ÅÓŠ×ćĮæµÄCuSO4ČÜŅŗŗĶ100g 10.00%µÄK2SO4ČÜŅŗ£¬a”¢b”¢c”¢d¾łĪŖŹÆÄ«µē¼«£®½ÓĶصēŌ“Ņ»¶ĪŹ±¼äŗ󣬲āµĆŅŅÖŠK2SO4ČÜŅŗÅضČĪŖ10.47%£¬¼×ÖŠaµē¼«µÄÖŹĮæŌö¼Ó£®ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£© £®¼×ŗĶ±ūæÉŠĪ³ÉĮ½ÖÖ»ÆŗĻĪļXŗĶY£¬XŗĶĖ®·“Ó¦ŗóÉś³ÉŅ»ÖÖ¾ßÓŠ»¹ŌŠŌµÄ¶žŌŖĖįM£®1molŅŅÓė×ćĮæ±ūæÉ»ÆŗĻÉś³ÉZ£¬ĖłµĆµÄZÓėČČĖ®·“Ó¦µÄ²śĪļWŠčÓĆ12mol KOH²ÅÄÜĶźČ«ÖŠŗĶ£®ŅŅŌŚ×ćĮæ¶”ÖŠČ¼ÉÕÉś³É»ÆŗĻĪļN£¬NŗĶĖ®·“Ӧɜ³ÉWŗĶDŌŖĖŲµÄĘųĢ¬Ēā»ÆĪļ£®ŹŌ»Ų“šĻĀĮŠĪŹĢā£ŗ
£®¼×ŗĶ±ūæÉŠĪ³ÉĮ½ÖÖ»ÆŗĻĪļXŗĶY£¬XŗĶĖ®·“Ó¦ŗóÉś³ÉŅ»ÖÖ¾ßÓŠ»¹ŌŠŌµÄ¶žŌŖĖįM£®1molŅŅÓė×ćĮæ±ūæÉ»ÆŗĻÉś³ÉZ£¬ĖłµĆµÄZÓėČČĖ®·“Ó¦µÄ²śĪļWŠčÓĆ12mol KOH²ÅÄÜĶźČ«ÖŠŗĶ£®ŅŅŌŚ×ćĮæ¶”ÖŠČ¼ÉÕÉś³É»ÆŗĻĪļN£¬NŗĶĖ®·“Ӧɜ³ÉWŗĶDŌŖĖŲµÄĘųĢ¬Ēā»ÆĪļ£®ŹŌ»Ų“šĻĀĮŠĪŹĢā£ŗ