
| A. | 1:1 | B. | 1:2 | C. | 3:2 | D. | 2:1 |
分析 依据题中信息印刷电路板中含有铜箔,刻制印刷电路时,铜和FeCl3溶液反应生成CuCl2和FeCl2 ,可写出化学反应方程式2FeCl3+Cu=2FeCl2+CuCl2 ,再改写为离子方程式为2Fe3++Cu=2Fe2++Cu2+;设已经反应的铁离子物质的量为x,未反应的铁离子浓度为y,根据反应的离子方程式及题中信息列式计算即可.
解答 解:设已经反应的铁离子物质的量为x,未反应的铁离子浓度为y,
2Fe3++Cu=2Fe2++Cu2+,
2 1
x $\frac{1}{2}$x
完全反应后,所得溶液中Cu2+和Fe3+的浓度恰好相等,即$\frac{1}{2}$x=y,
则已反应的Fe3+和未反应的Fe3+的物质的量之比为 x:y=1:$\frac{1}{2}$=2:1,
故选D.
点评 本题考查了离子方程式的简单计算,题目难度中等,注意明确铁离子与铜反应原理,理解题中反应关系及题干信息是解题关键,试题充分考查了学生的分析、理解能力及灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 用广泛pH试纸测得0.05mol•L-1 H2SO4溶液的pH=1 | |
| B. | 做焰色反应实验时,透过蓝色钴玻璃,观察到火焰颜色为紫色,证明被检验物一定为钾盐 | |
| C. | 滴定过程中,眼睛要始终注视锥形瓶中液体的颜色变化 | |
| D. | 配制FeSO4溶液时,先将FeSO4固体溶解在稀硫酸中,然后稀释到所需浓度,最后再加入少量铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +1 | B. | +2 | C. | +3 | D. | +4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
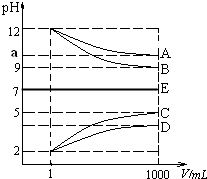 物质A~E都是由NH4+、H+、Na+、OH-、CH3COO-、Cl-中离子两两组成(离子可重复,如NaCl、HCl).常温下将各物质的溶液从1mL稀释到1000mL,pH的变化如甲图所示.请回答:
物质A~E都是由NH4+、H+、Na+、OH-、CH3COO-、Cl-中离子两两组成(离子可重复,如NaCl、HCl).常温下将各物质的溶液从1mL稀释到1000mL,pH的变化如甲图所示.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA | |
| B. | 标准状况下,11.2 LSO3含有的分子数目为0.5 NA | |
| C. | 7.8gNa2O2所含的离子数为0.4NA | |
| D. | 11.2LCl2完全溶于NaOH溶液,电子转移数为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Cl-)=c(NH3•H2O)+c(NH4+) | |
| B. | c(Cl-)>c(NH4+)>c(Na+)>c(NH3•H2O)>c(OH-)>c(H+) | |
| C. | c(Cl-)+c(OH-)=c(Na+)+c(NH4+)+c(H+) | |
| D. | c(NH3•H2O)+c(OH-)=c(Na+)+c(NH4+)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| F | Cl | Br | I | |
| 第一电离能((kJ•mol-1)) | 1681 | 1251 | 1140 | 1008 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com