
| ① | |||||||||||||||||
| ⑥ | ⑦ | ||||||||||||||||
| ② | ④ | ⑤ | ⑧ | ||||||||||||||
| ③ | ⑩ | ||||||||||||||||
| ⑨ | |||||||||||||||||
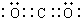 ,
,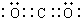 ;
;

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:
| A、金属钠着火时用水扑灭 |
| B、苯酚不慎沾到皮肤上,立即用酒精洗涤 |
| C、浓硫酸不慎沾到皮肤上,立即用大量水冲洗 |
| D、不慎接触过多的氨而使眼睛不适,立即用大量水冲洗眼睛 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
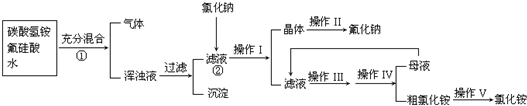
查看答案和解析>>
科目:高中化学 来源: 题型:
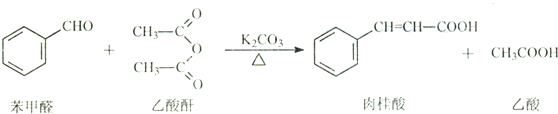
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
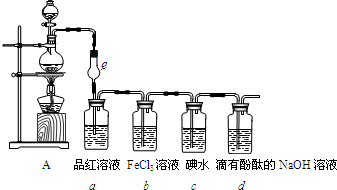 某化学兴趣小组探究SO2和Cl2的化学性质,他们使用的装置和药品如图所示:
某化学兴趣小组探究SO2和Cl2的化学性质,他们使用的装置和药品如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
 科学研究发现Cu2O可作为太阳光分解水的催化剂.
科学研究发现Cu2O可作为太阳光分解水的催化剂.| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com