
下表为长式周期表的一部分,其中的编号代表对应的元素。
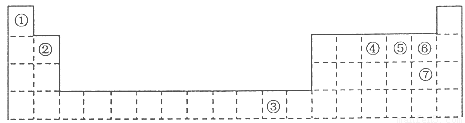
(1)元素③基态原子的电子排布式为???????? 。
(2)②与⑦形成的化合物的空间构型为?????? 。
(3)元素②④⑤⑥的第一电离能由大到小的顺序是?????? (填元素符号)
(4)在测定①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因???????????? 。
(5)胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4·H2O,其结构如图所示。下列说法正确的是???????
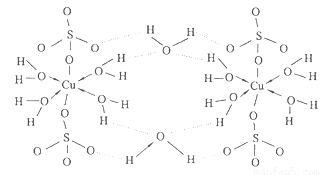
a.在上述结构示意图中,所有氧原子都采用sp3杂化
b.在上述结构示意图中,存在配位键、共价键和离子键
c.胆矾是分子晶体,分子间存在氢键
d.胆矾中的水在不同温度下会分步失去
(6)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是????????? 。
(1)1s22s22p63s23p63d104s1;
(2)直线型;
(3)F>N>O>Be;
(4)因为HF分子在气相时会通过氢键二聚或多聚,导致实测相对分子质量偏大;
(5)bd;
(6)N、F、H三种元素的电负性:F>N>H,在NF3中,共用电子对偏向F,偏离N原子使得氮原子上的孤对电子难于与Cu2+形成配位键。
【解析】
试题分析:根据元素周期表的结构及常见元素在元素周期表中的位置判断,①为氢元素,②为铍元素,③为铜元素,④为氮元素,⑤为氧元素,⑥为氟元素,⑦为氯元素。(1)元素③为铜元素,基态原子的电子排布式为1s22s22p63s23p63d104s1;(2)根据价层电子对互斥理论判断,②与⑦形成的化合物BeCl2的空间构型为直线型;(3)根据同周期元素性质递变规律判断:同周期由左向右第一电离能呈递增趋势,但氮元素原子最外层p轨道为半充满状态,较稳定,第一电离能比相邻的氧元素大,元素②④⑤⑥的第一电离能由大到小的顺序是F>N>O>Be;(4)在测定①与⑥形成化合物HF的相对分子质量时,实验测得的值一般高于理论值的主要原因是因为HF分子在气相时会通过氢键二聚或多聚,导致实测相对分子质量偏大;(5)a.由题给结构判断,只有H2O中的氧原子和SO42—中的2个羟基氧为饱和氧原子,采用sp3杂化,错误;b.在上述结构示意图中,存在配位键、共价键和离子键,正确;c.胆矾是离子晶体,错误;d.胆矾中的水在不同温度下会分步失去,正确,选bd;(6)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是N、F、H三种元素的电负性:F>N>H,在NF3中,共用电子对偏向F,偏离N原子使得氮原子上的孤对电子难于与Cu2+形成配位键。
考点:考查物质结构与性质,涉及元素推断、元素周期律、分子空间构型、化学键和氢键等。


科目:高中化学 来源: 题型:阅读理解



| 电离能I(eV) | A | B | C | D | E | F |
| I1 | 11.3 | 14.5 | 13.6 | 5.2 | 7.6 | 6.0 |
| I2 | 24.4 | 29.6 | 35.1 | 49.3 | 15.0 | 18.8 |
| I3 | 47.9 | 47.4 | 54.9 | 71.6 | 80.1 | 28.4 |
| I4 | 64.5 | 77.5 | 77.4 | 98.9 | 109.2 | 112.0 |
| I5 | 392.1 | 97.9 | 113.9 | 138.3 | 141.3 | 153.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | |||||||||||||||||
| ② | ③ | ④ | ⑤ | ⑥ | |||||||||||||
| ⑦ | ⑧ | ⑨ | |||||||||||||||
| ⑩ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com