D
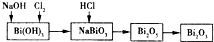
分析:A.有元素化合价变化的反应为氧化还原反应;
B.氧化剂的氧化性大于氧化产物的氧化性;
C.Cl2+Bi(OH)3+3NaOH=NaBi03+2NaCl+3H2O;
D.根据化合价的变化计算转移的电子数.
解答:A.上述反应中只有Bi(OH)3→NaBi03、Bi205→Bi203两个反应为氧化还原反应,故A错误;
B.氧化剂的氧化性大于氧化产物的氧化性可知,氧化性:Cl2>NaBi03>Bi203,故B错误;
C.由Cl2+Bi(OH)3+3NaOH=NaBi03+2NaCl+3H2O可知,NaBi03的化学计量数为1,故C错误;
D.得到0.05molBi203时,上述过程中共转移电子0.01mol×(5-3)+0.01mol×(5-3)=0.04mol,故D正确;
故选D.
点评:本题以信息的形式考查氧化还原反应,明确发生的反应及反应中元素的化合价变化即可解答,题目难度不大,选项D为解答的难点.



 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案