
【题目】溴及其化合物用途十分广泛,我国正在大力开展海水提溴的研究和开发工作。工业以浓缩海水为原料提取溴的部分过程如下:
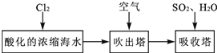
某课外小组在实验室模拟上述过程设计以下装置进行实验(所有橡胶制品均已被保护,夹持装置已略去)
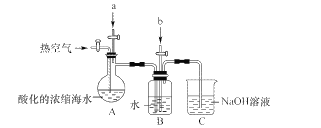
(1)A装置中通入a气体的目的是(用离子方程式表示)____。
(2)A装置中通入a气体一段时间后,停止通入,改通热空气。通入热空气的目的是____。
(3)B装置中通入的b气体是____,目的是使溴蒸气转化为氢溴酸以达到富集的目的,试写出该反应的化学方程式____。
(4)C装置的作用是____。
【答案】 Cl2+2Br-=2Cl-+Br2 吹出Br2 SO2 Br2+SO2+2H2O=2HBr+H2SO4 吸收未反应的Cl2、Br2、SO2,防污染
【解析】由流程可知,氯气与浓缩海水中溴离子发生氧化还原反应生成溴,在吹出塔中富集溴,然后在吸收塔中溴、二氧化硫和水发生氧化还原反应生成硫酸和HBr;由实验装置可知,a为氯气,可氧化溴离子,热空气可将生成的溴蒸气吹出,气体b为二氧化硫,在B装置中发生氧化还原反应生成硫酸和HBr,C装置为尾气处理装置,吸收氯气、二氧化硫、溴等,以此来解答。
(1)要想使溴离子变成溴单质,则加入的a能和溴离子发生反应生成溴单质,氯气能和溴离子发生置换反应生成溴单质,离子反应方程式为Cl2+2Br-=2Cl-+Br2;
(2)溴易挥发,升高温度促进其挥发,所以通入热空气的目的是吹出Br2;
(3)使溴蒸气转化为氢溴酸以达到富集的目的,可知气体b为SO2,发生的反应为Br2+SO2+2H2O=2HBr+H2SO4;
(4)氯气不可能完全反应,氯气和溴离子反应生成溴单质,未反应的二氧化硫、氯气和溴都有毒,不能直接排入空气中,且这几种物质都能和碱反应,所以C装置是尾气处理装置,可知C的作用为吸收未反应的Cl2、Br2、SO2,防污染。


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】CO、CO2是化石燃料燃烧的主要产物。
(1)将含0.02 molCO2和0.01molCO的混合气体通入有足量Na2O2 固体的密闭容器中,同时不断地用电火花点燃,充分反应后,固体质量增加_________g。
(2)已知:2CO(g)+O2(g)=2CO2(g) △H=-566.0 kJ·mol-1,键能Eo-o=499.0kJ·mol-1。
①反应:CO(g)+O2(g)![]() CO2(g)+O(g)的△H=_________kJ·mol-1。
CO2(g)+O(g)的△H=_________kJ·mol-1。
②已知2500K时,①中反应的平衡常数为0.40,某时刻该反应体系中各物质浓度满足:c(CO)·c(O2)=c(CO2)·c(O),则此时v(正)_________(填“>” 、“<”或“=”)v(逆)。
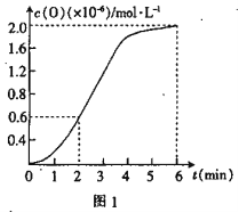
③已知1500℃时,在密闭容器中发生反应:CO2(g)![]() CO(g)+O(g)。反应过程中O(g)的 物质的量浓度随时间的变化如图1 所示,则0~2 min 内,CO2 的平均反应速率 v(CO2)=_________。
CO(g)+O(g)。反应过程中O(g)的 物质的量浓度随时间的变化如图1 所示,则0~2 min 内,CO2 的平均反应速率 v(CO2)=_________。
(3)在某密闭容器中发生反应:2CO2(g)![]() 2CO(g)+O2(g),1molCO2 在不同温度下的平衡分解量如图2 所示。
2CO(g)+O2(g),1molCO2 在不同温度下的平衡分解量如图2 所示。

①恒温恒容条件下,能表示该可逆反应达到平衡状态的有_________ (填字母)。
A.CO 的体积分数保持不变
B.容器内混合气体的密度保持不变
C.容器内混合气体的平均摩尔质量保持不变
D.单位时间内,消耗CO 的浓度等于生成CO2 的浓度
②分析图2,若1500℃时反应达到平衡状态,且容器体积为1L,则此时反应的平衡常数 K=_________(计算结果保留1 位小数)。
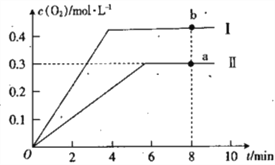
③向恒容密闭容器中充入2molCO2(g),发生反应:2CO2(g)![]() 2CO(g)+O2(g),测得温度为T℃时,容器内O2的物质的量浓度随时间的变化如曲线II 所示。图中曲线I 示相对于曲线II仅改变一种反应条件后c(O2)随时间的变化,则改变的条件是_________;a、 两点用CO浓度变化表示的净反应速率关系为va(CO)_________(填“>”“<”或“=”) vb( CO)。
2CO(g)+O2(g),测得温度为T℃时,容器内O2的物质的量浓度随时间的变化如曲线II 所示。图中曲线I 示相对于曲线II仅改变一种反应条件后c(O2)随时间的变化,则改变的条件是_________;a、 两点用CO浓度变化表示的净反应速率关系为va(CO)_________(填“>”“<”或“=”) vb( CO)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 等质量的甲烷和乙烯完全燃烧,甲烷消耗的O2多
B. C5H11Cl有6种同分异构体
C. 聚乙烯与乙烯性质相似,可使溴水褪色
D. 正丁烷和异丁烷互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从能量的变化和反应的快慢等角度研究化学反应具有重要意义。
(1)已知一定条件下,反应N2+3H2=2NH3为放热反应:
①下图能正确表示该反应中能量变化的是____;
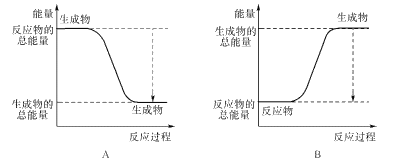
②根据下表数据,计算生成1 molNH3时该反应放出的热量为____kJ;

③一定温度下,将3 molH2和1 molN2通入容积为2L的密闭容器中发生反应,5 min达到平衡,测得c(NH3)=0.6 mol/L,则0至5 min时v(N2)=___,达到平衡时H2的转化率为____。
(2)某兴趣小组为研究原电池原理,设计如图装置。
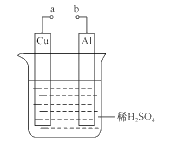
①a和b用导线连接,Cu极为原电池____极(填“正”或“负”),电极反应式是____;Al极发生____(填“氧化”或“还原”)反应,其电极反应式为____,溶液中SO42-移向____(填“Cu”或“Al”极)。溶液pH____(填增大或减小);当负极金属溶解5.4g时,____NA电子通过导线。
②不将a、b连接,请问如何加快Al与稀硫酸的反应速率?_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学键的叙述,正确的是( )
A.硫酸氢钠溶于水既有离子键被破坏又有共价键被破坏
B.单质分子中均含共价键
C.HF与HBr相比,分子内共价键更强,所以HF沸点更高
D.由不同元素组成的多原子分子里,只存在极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
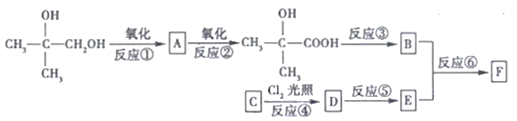
【题目】有机物F(C11H12O2)属于芳香酯类物质,可由下列路线合成:
请回答下列问题:
(1)A中官能团的名称是__________,上述③④⑤⑥中属于取代反应的是_______________。
(2)C物质的名称是_______,反应③的条件是________________________。
(3)B在一定条件下可以形成高分子化合物,写出此过程的化学方程式:_________________。
(4)反应⑥的化学方程式为___________________________________。
(5)A、B、E三种有机物,可用下列的某一种试剂鉴别,该试剂是_______________________。
a.新制的Cu(OH)2悬浊液 b.溴水
c.酸性KMnO4溶液 d.溴的CC14溶液
(6)G是E的同系物且相对分子质量比E大28。G有多种同分异构体,其中符合下列条件的同分异构体有____种,其中核磁共振氢谱有5组峰,且面积比为6:1:2:2:1的结构简式为_____________________。
①能与Na2CO3溶液反应 ②分子中含有两个一CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述与胶体性质有关的是( )
A.利用醋酸除去锅炉中的水垢
B.家用滤芯式净水器中利用活性炭净水
C.清晨在树林中可以看到一缕缕光束
D.向氯化铁溶液中滴加氢氧化钠溶液产生红褐色沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com