
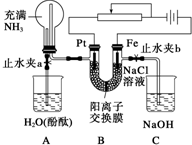
 某课外活动小组设计了如图所示的装置,调节滑动变阻器,控制电流强度适中的情况下用其进行缓慢电解NaCl溶液及相关实验(此时,打开止水夹a,关闭止水夹b).由于粗心,实验并未达到预期目的,但也看到了令人很高兴的现象(阳离子交换膜只允许阳离子和水通过).
某课外活动小组设计了如图所示的装置,调节滑动变阻器,控制电流强度适中的情况下用其进行缓慢电解NaCl溶液及相关实验(此时,打开止水夹a,关闭止水夹b).由于粗心,实验并未达到预期目的,但也看到了令人很高兴的现象(阳离子交换膜只允许阳离子和水通过).

科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 2 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 稀硫酸 |
| △ |
| NaOH溶液 |
| 碘水 |
| 稀硫酸 |
| △ |
| 银氨溶液 |
| 微热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com