
| A. | 所含氧原子的个数比为2:3 | B. | 所含硫原子的个数比为1:1 | ||
| C. | 所含氧元素的质量比为5:6 | D. | 所含硫元素的质量比为5:4 |
分析 根据n=$\frac{m}{M}$计算等质量的SO2和SO3的物质的量之比,结合分子式计算含有氧原子、S原子数目之比,再根据m=nM计算氧元素、S元素质量之比.
解答 解:根据n=$\frac{m}{M}$可知,等质量的SO2和SO3的物质的量之比为80g/mol:64g/mol=5:4.
A.等质量的SO2和SO3 所含氧原子的个数比为5×2:4×3=5:6,故A错误;
B.等质量的SO2和SO3 所含硫原子的个数比为5×1:4×1=5:4,故B错误;
C.等质量的SO2和SO3 所含氧元素质量之比为5mol:6mol=5:6,故C错误;
D.等质量的SO2和SO3 所含硫元素质量之比为5mol:4mol=5:4,故D错误,
故选:CD.
点评 本题考查物质的量的有关计算等,难度不大,可以质量分数计算氧元素、硫元素质量之比.


科目:高中化学 来源: 题型:选择题
| A. | 温度相同,体积相同的O2和N2 | |
| B. | 质量相等,密度不等的N2和CO | |
| C. | 体积相等,密度相等的CO和C2H4 (C2H4 为乙烯气体) | |
| D. | 压强相同、体积相同的N2和O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(PO43-):Na3PO4>Na2HPO4>NaH2PO4>H3PO4 | |
| B. | c(CO32-):(NH4)2CO3>Na2CO3>NaHCO3>NH4HCO3 | |
| C. | c(NH4+):(NH4)2SO4>(NH4)2CO3>NH4HSO4>NH4Cl | |
| D. | c(S2-):Na2S>NaHS>H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H2、H2S、C2H4 | B. | H2、CO2、H2S | C. | HCl、CO2、O2 | D. | H2、NO2、CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸(CH3COOH) | B. | 氨基乙酸(H2N-CH2-COOH) | ||
| C. | 尿素(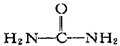 ) ) | D. | 硝化甘油(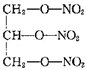 ) ) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.5moL/L的AlCl3溶液中含有氯离子数为1.5NA | |
| B. | 25℃,1.01×105 Pa,64 g SO2中含有的原子数为3NA | |
| C. | 25℃,1.01×105 Pa,11.2 L Cl2含有的氯原子数为1.0 NA | |
| D. | 1 L 0.1 mol/LNaCl溶液中所含的Na+ 的电子数为1.0NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.45mol/(L•min) | B. | 0.55mol/(L•min) | C. | 0.60mol/(L•min) | D. | 0.90mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 立方氮化硼是一种超硬材料,可由:2Mg3B2N4+3O2 $\frac{\underline{\;\;\;\;\;高温,加热\;\;\;\;\;}}{添加剂,催化剂}$6MgO+4BN+2N2制备.
立方氮化硼是一种超硬材料,可由:2Mg3B2N4+3O2 $\frac{\underline{\;\;\;\;\;高温,加热\;\;\;\;\;}}{添加剂,催化剂}$6MgO+4BN+2N2制备.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

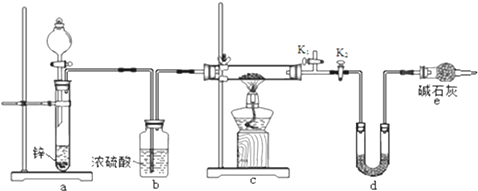
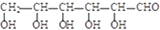 碱性条件下氧化为
碱性条件下氧化为 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com