
A、C+O2
| ||||
B、CH4+2O2
| ||||
| C、CaO+H2O=Ca(OH)2 | ||||
D、CuO+H2
|
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、平衡向逆反应方向移动 |
| B、x+y>z |
| C、B的物质的量增大 |
| D、C的体积分数保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、乙炔的分子结构模型示意图: |
| B、二硫化碳的结构式:S═C═S |
C、NH4Cl的电子式: |
D、2-甲基丁醇的结构简式: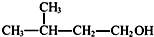 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能使湿润的蓝色石蕊试纸先变红后褪色 |
| B、使沾有酸性高锰酸钾溶液的滤纸褪色,证明了二氧化硫的漂白性 |
| C、使品红试纸褪色,证明了二氧化硫的漂白性 |
| D、沾有酚酞和NaOH 溶液的滤纸褪色,证明了二氧化硫具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、M元素的离子可表示为M2+ |
| B、Z化学式可表示为MN2 |
| C、Z一定能溶于水 |
| D、Z一定为离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)已知:①Mg(s)+Cl2(g)=MgCl2(s)△H=-641kJ?mol-1.
(1)已知:①Mg(s)+Cl2(g)=MgCl2(s)△H=-641kJ?mol-1.| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com