


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
| A、元素的种类由核内质子数决定 |
| B、原子的种类由核内质子数和中子数共同决定 |
| C、分子的种类由分子的组成决定 |
| D、原子的质量主要由原子核中质子和中子决定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-19 |
| AlAsO4 | 1.6×10-16 |
| FeAsO4 | 5.7×10-21 |
| 污染物 | H2SO4 | As |
| 浓度 | 28.42g/L | 1.6g?L-1 |
| 排放标准 | pH 6~9 | 0.5mg?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
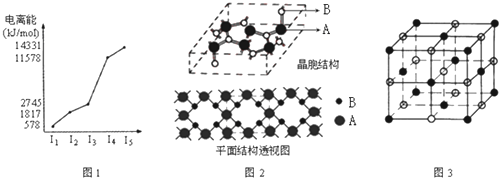
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
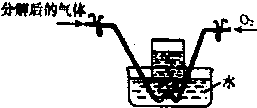 已知Fe(NO3)2受热分解产物为金属氧化物、NO2、O2.某兴趣小组同学对固体产物中Fe的化合物进行了如下探究:
已知Fe(NO3)2受热分解产物为金属氧化物、NO2、O2.某兴趣小组同学对固体产物中Fe的化合物进行了如下探究:查看答案和解析>>
科目:高中化学 来源: 题型:
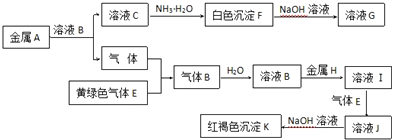
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、减少化石燃料的使用能减轻温室效应 |
| B、酸雨是指PH值小于7的雨水 |
| C、对煤炭进行脱硫处理后再做燃料能有效减少酸雨 |
| D、使用无氟冰箱可减缓臭氧空洞的产生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com