
| A. | 静置后的淘米水能产生丁达尔现象,这种“淘米水”是胶体 | |
| B. | “洁厕灵”有效成分为盐酸,与漂白粉混合使用效果更佳 | |
| C. | 新型能源生物柴油和矿物油主要化学成分相同 | |
| D. | 铝热反应中可得到铁,工业上可以利用该反应来大量生产铁 |
分析 A、丁达尔效应是胶体所特有的性质;
B、漂白粉中含氯离子和次氯酸根;
C、生物柴油是生物质能的一种,它是生物质利用热裂解等技术得到的一种长链脂肪酸的单烷基酯,矿物油的成分为多种烃混合物;
D、工业用CO为还原剂大量生产铁.
解答 解:A、丁达尔效应是胶体所特有的性质,故静置后的淘米水能发生丁达尔效应,则说明淘米水是胶体,故A正确;
B、漂白粉中含氯离子和次氯酸根,两者在酸性环境下不能共存,会发生归中反应生成氯气,故B错误;
C、生物柴油是指以油料作物、野生油料植物和工程微藻等水生植物油脂以及动物油脂、餐饮垃圾油等为原料油通过酯交换工艺制成的可代替石化柴油的再生性柴油燃料,是一种长链脂肪酸的单烷基酯,而矿物油的成分为多种烃混合物,两者成分不同,故C错误;
D、工业用CO为还原剂大量生产铁,而铝热法由于成本高,故常用于小规模的焊接钢轨,故D错误.
故选A.
点评 本题考查了化学知识在生活中的应用,难度不大,应注意基础知识的积累和对生活经验的观察.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知:2CrO42-+2H+?Cr2O72-+H2O.25℃时,调节初始浓度为1.0mol•L-1 的Na2CrO4溶液的pH,测定平衡时溶液中c(Cr2O72-)和c(H+),获得如图所示的曲线.下列说法不正确的是( )
已知:2CrO42-+2H+?Cr2O72-+H2O.25℃时,调节初始浓度为1.0mol•L-1 的Na2CrO4溶液的pH,测定平衡时溶液中c(Cr2O72-)和c(H+),获得如图所示的曲线.下列说法不正确的是( )| A. | 平衡时,pH越小,c(Cr2O72-)越大 | |
| B. | A点CrO42-的平衡转化率为50% | |
| C. | A点CrO42-转化为Cr2O72-反应的平衡常数K=1014 | |
| D. | 平衡时,若溶液中c(Cr2O72-)=c(Cr2O42-),则c(H+)>2.0×10-7 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO是还原剂 | B. | Fe2O3被还原 | ||
| C. | 属于氧化还原反应 | D. | 属于置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
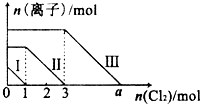 向仅含Fe2+,I-,Br-的溶液中通入适量的氯气,溶液中这种离子的物质的量随消耗氯气物质的量的变化如图所示.下列说法中正确的是( )
向仅含Fe2+,I-,Br-的溶液中通入适量的氯气,溶液中这种离子的物质的量随消耗氯气物质的量的变化如图所示.下列说法中正确的是( )| A. | 线段Ⅲ代表Fe2+的变化情况 | B. | 原混合溶液中n(FeBr2)=4mol | ||
| C. | 线段Ⅰ代表Br-的变化情况 | D. | a值等于6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和10 mL 0.1mol•L-1 醋酸与中和100 mL 0.01mol•L-1 的醋酸所需同种碱溶液的用量不同 | |
| B. | 两种醋酸溶液的物质的量浓度分别c1和c2,pH分别为a和a+1,则c1=10c2 | |
| C. | 常温下,pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 | |
| D. | 向0.1mol/L的氨水中加入少量硫酸铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com