
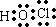 ,结构式为H-O-Cl,
,结构式为H-O-Cl,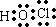 ;H-O-Cl;
;H-O-Cl; ,
, ;
; ,
, ;
;

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
| A、镀锌铁和镀锡铁的镀层破损后,前者较易被腐蚀 |
| B、火电是将燃料中的化学能直接转化为电能的过程 |
| C、将煤粉碎了再燃烧可以提高煤的燃烧效率 |
| D、化学反应的限度不可以通过改变条件而改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 |
B、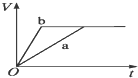 |
C、 |
D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E元素+3价离子外围电子排布式为3d5.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E元素+3价离子外围电子排布式为3d5.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com