
| A | B | C | D |
 |
 |
 |
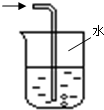 |
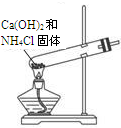
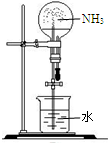
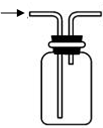
| 实验室制NH3 | 证明NH3极易溶于水 | 收集NH3 | 吸收多余NH3 |
| A、A | B、B | C、C | D、D |


科目:高中化学 来源: 题型:
| A、CO2(H2S):通过CuSO4溶液 |
| B、CH3COOH(H2O):加新制生石灰,蒸馏 |
| C、苯(甲苯):加酸性高锰酸钾溶液、再加NaOH溶液,分液 |
| D、MgCl2溶液(Fe3+):加MgO,过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 火力发电厂释放出大量氮氧化物(NOx)、SO2和CO2等气体会造成环境问题.对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的.
火力发电厂释放出大量氮氧化物(NOx)、SO2和CO2等气体会造成环境问题.对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的.| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 25℃时,由弱酸(HA)及其盐(NaA)组成的混合溶液,起始浓度均为1mol?L-1.如图为向该溶液中通入HCl气体或加入NaOH固体时,溶液pH随加入H+或OH-的物质的量而变化的曲线.下列说法中,正确的是( )
25℃时,由弱酸(HA)及其盐(NaA)组成的混合溶液,起始浓度均为1mol?L-1.如图为向该溶液中通入HCl气体或加入NaOH固体时,溶液pH随加入H+或OH-的物质的量而变化的曲线.下列说法中,正确的是( )| A、加NaOH,HA电离平衡常数增大 |
| B、通入HCl,溶液中阴离子浓度之和减小 |
| C、溶液中水的电离程度a>b>c |
| D、b点溶液中,c(HA)<c(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | HA物质的量浓度(mol?L-1) | NaOH物质的量浓度(mol?L-1) | 混合溶液的pH |
| ①②③ | 0.1 | 0.1 | pH=9 |
| C | 0.2 | pH=7 | |
| 0.2 | 0.1 | pH<7 |
| A、HA的电离方程式为:HA?H++A- |
| B、不考虑其他组的实验结果,c≥0.2 |
| C、③组实验中,混合溶液中c(A-)>c(Na+)>c(HA)>c(H+)>c(OH-) |
| D、①组实验中,混合溶液中c(A-)=(0.1+10-9-10-5)mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH4与SiH4的稳定性:CH4>SiH4 |
| B、HClO与H2SO4的酸性:HClO>H2SO4 |
| C、1mol HCl(g)的能量比1mol H2(g)和1mol Cl2(g)的能量和高 |
| D、Cl与S的原子半径:Cl>S |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L SO3中含有的氧原子数为3NA |
| B、标准状况下,22.4L Cl2与足量的稀NaOH 溶液反应,转移电子总数为2NA |
| C、1mol N5+共有34NA核外电子 |
| D、0.5mol CCl4中含有共价键数目为4NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com