
【题目】K2Cr2O7溶液中存在平衡:![]() (橙色)+H2O2
(橙色)+H2O2![]() (黄色)+2H+,用K2Cr2O7溶液进行下列实验:
(黄色)+2H+,用K2Cr2O7溶液进行下列实验:
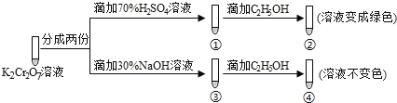
下列说法正确的是
A.①中溶液变黄,③中溶液橙色加深
B.②中![]() 被C2H5OH氧化
被C2H5OH氧化
C.若向④中加入70%H2SO4溶液至过量,溶液变为绿色
D.K2Cr2O7在碱性条件下的氧化性比酸性条件更强
科目:高中化学 来源: 题型:
【题目】分别调节0.01mol·L-1HCOOH溶液、0.01mol·L-1氨水的pH,系统中微粒浓度的负对数值(-lgc)与pH的关系分别如下图所
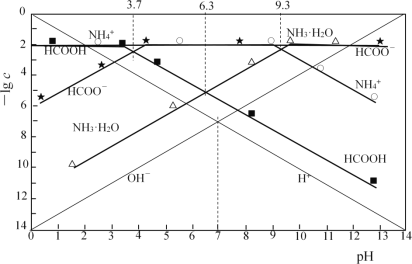
下列说法错误的是
A. 25℃时,NH3·H2O![]() NH4++OH-的lgK=-4.7
NH4++OH-的lgK=-4.7
B. 25℃时,0.01mol·L-1HCOOH溶液的pH为3.7
C. HCOONa溶液中加入NH4Cl至溶液呈中性:c(Cl-)>c(Na+)>c(HCOO-)
D. HCOONa溶液中加入KHSO3至溶液呈中性:c(HCOOH) +c(H2SO3) = c(SO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.升高H2SO4稀溶液温度,溶液中c(OH-)增大
B.pH=3的CH3COOH溶液加入CH3COONa固体,溶液的pH减小
C.NaClO稀溶液中加入NaClO固体,溶液中![]() 增大
增大
D.向AgCl、Ag2CrO4的饱和溶液中加入少量AgNO3固体,溶液中![]() 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A.24g镁与27g铝中,质子数之比为12∶13
B.相同质量的16O2和18O2,体积比为9∶8
C.将1LCmol·L-1氯化钠溶液加入水中稀释为5L,得到0.2Cmol·L-1氯化钠溶液
D.同温同压时,H2和CH4两种气体的密度之比为1∶8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究外界条件对反应:mA(g) +nB(g)![]() cZ(g) △H的影响,以A和B物质的量之比为 m:n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示。下列判断正确的是( )
cZ(g) △H的影响,以A和B物质的量之比为 m:n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示。下列判断正确的是( )
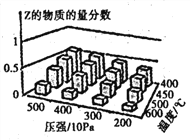
A.在恒温恒容条件下,向已达到平衡的体系中加入少量Z,平衡正向移动,Z的含量增大
B.升高温度,正、逆反应速率都增大,平衡常数增大
C.△H<0 m + n >c
D.△H>0 m +n<c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬(Cr)在自然界主要以+3价和+6价存在。请回答下列问题:
(1)利用铬铁矿(FeO·Cr2O3)冶炼制取金属铬的工艺流程如图所示:
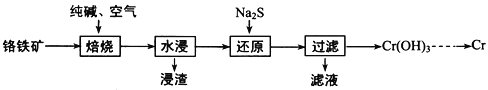
①为加快焙烧速率和提高原料的利用率,可采取的措施之一是_________。
②“水浸”要获得浸出液的操作是________。
(2)常温下,已知Cr3+完全沉淀时溶液pH为5,(Cr3+浓度降至10-5mol·L-1可认为完全沉淀)则Cr(OH)3的溶度积常数Ksp=___。
(3)用石墨电极电解铬酸钠(Na2CrO4)溶液,可制重铬酸钠(Na2Cr2O7),实验装置如图所示(已知:2![]() +2H+2
+2H+2![]() +2H2O)
+2H2O)
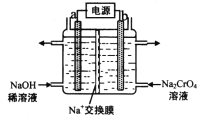
①电极b连接电源的______极(填“正”或“负),b极发生的电极反应:________
②电解一段时间后,测得阳极区溶液中Na+物质的量由amol变为bmol,则理论上生成重铬酸钠的物质的量是________mol(用含a、b的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某矿石的主要成分是BaCO3(含Ca2+、Mg2+、Fe3+等杂质)。实验室利用该矿石制备BaCl2·2H2O的流程如图:
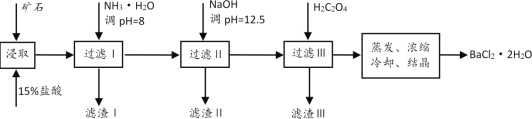
(1)用稀盐酸浸取前需充分研磨矿石,目的是__。
(2)加入NH3·H2O调节pH=8可除去__(填离子符号),滤渣Ⅱ中含__(填化学式)。
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
(3)要使Ca2+完全沉淀,应控制溶液中的![]() 的浓度不低于__mol/L(离子浓度小于1×10-5mol/L时,认为沉淀就达完全);同时加入H2C2O4时又应避免过量,原因是__。(已知:KSP(BaC2O4=1.6×10-7,KSP(CaC2O4=2.3×10-9)。
的浓度不低于__mol/L(离子浓度小于1×10-5mol/L时,认为沉淀就达完全);同时加入H2C2O4时又应避免过量,原因是__。(已知:KSP(BaC2O4=1.6×10-7,KSP(CaC2O4=2.3×10-9)。
(4)利用氧化还原滴定法可测定H2C2O4的浓度,取20.00mLH2C2O4溶液于锥形瓶中,用0.10mol/L酸性KMnO4溶液滴定,KMnO4溶液应装在__(填“酸式滴定管”或“碱式滴定管”)中。写出反应的离子方程式为__。滴定终点的现象为__。若滴定达到终点时,消耗KMnO4溶液30.00mL,则H2C2O4溶液的浓度为__mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 已知HI(g) ![]() 1/2H2(g)+1/2I2(s) ΔH=-26.5 kJ·mol-1,由此可知1 mol HI气体在密闭容器中充分分解后可以放出26.5 kJ的热量
1/2H2(g)+1/2I2(s) ΔH=-26.5 kJ·mol-1,由此可知1 mol HI气体在密闭容器中充分分解后可以放出26.5 kJ的热量
B. 已知2H2(g)+O2(g)===2H2O(g) ΔH=-571.6 kJ·mol-1,则氢气的燃烧热为ΔH=-285.8 kJ·mol-1
C. 已知2C(s)+2O2(g)=2CO2(g) ΔH1, 2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1<ΔH2
D. 含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)===CH3COONa(aq)+H2O(l) ΔH=-57.4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冰晶石又名六氟铝酸钠(Na3AlF6),白色固体,微溶于水,常用作电解铝工业的助熔剂。工业上用萤石(主要成分是CaF2)、浓硫酸、氢氧化铝和碳酸钠溶液通过湿法制备冰晶石,某化学实验小组模拟工业上制取Na3AlF6的装置图如图(该装置均由聚四氟乙烯仪器组装而成)。
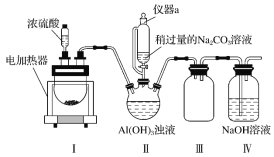
已知:CaF2+H2SO4![]() CaSO4+2HF↑
CaSO4+2HF↑
(1)装置Ⅲ的作用为__。
(2)在实验过程中,装置Ⅱ中有CO2气体逸出,同时观察到有白色固体析出,请写出该反应的离子方程式:__。
(3)在实验过程中,先向装置Ⅱ中通入HF气体,然后再滴加Na2CO3溶液,而不是先将Na2CO3和Al(OH)3混合后再通入HF气体,其原因是__。
(4)装置Ⅱ反应后的混合液经过过滤可得到Na3AlF6晶体,在过滤操作中确定沉淀已经洗涤干净的方法是__。
(5)萤石中含有少量的Fe2O3杂质,可用装置Ⅰ反应后的溶液来测定氟化钙的含量。具体操作如下:取8.0g萤石加入装置Ⅰ中,完全反应后,将混合液加水稀释,然后加入足量的KI固体,再以淀粉为指示剂,用0.1000mol·L-1 Na2S2O3标准溶液滴定,当出现__现象时,到达滴定终点,消耗Na2S2O3标准溶液40.00mL,则萤石中氟化钙的百分含量为__。(已知:I2+2![]() =
=![]() +2I-)
+2I-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com