
| A. | Fe分别与氯气和稀盐酸反应所得氯化物相同 | |
| B. | 常温下干燥的Cl2能用钢瓶贮运,所以Cl2不与铁反应 | |
| C. | 氯气具有漂白性 | |
| D. | 根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO |
分析 A.氯气具有强氧化性,与铁反应生成氯化铁;
B.氯气与铁在点燃条件下反应;
C.氯气本身不具有漂白性;
D.反应进行符合复分解反应的规律.
解答 解:A.铁与强氧化剂反应生成+3价化合物,氯气具有强氧化性,与铁反应生成氯化铁,铁与盐酸反应生成氯化亚铁,故A错误;
B.氯气与铁在点燃条件下反应,但常温下干燥的氯气与铁不反应,故B错误;
C.氯气本身不具有漂白性,与水反应生成具有漂白性的HClO,故C错误;
D.CO2通入NaClO溶液中能生成HClO,符合复分解反应的条件,为强酸可以制取较弱酸的规律,故D正确.
故选D.
点评 本题综合考查元素化合物知识,为高考常见题型,侧重于学生的分析能力以及元素化合物知识的综合理解和运用的考查,注意相关基础知识的积累,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在潮湿的环境中,铜容易发生析氢腐蚀形成铜绿 | |
| B. | 常温下,将pH=4的醋酸溶液稀释后,电离平衡右移,所有离子的浓度均降低 | |
| C. | 反应SiO2(s)3C(s)=SiC(s)+2CO(g)室温下不能自发进行,则该反应的△H<0 | |
| D. | 等体积、等物质的量浓度的NH3•H2O溶液与NH4Cl溶液混合后溶液呈碱性,说明NH3•H2O的电离程度大于NH${\;}_{4}^{+}$的水解程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 | B. | 20 | C. | 30 | D. | 40 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷与四氯化碳分子都是含有极性键的极性分子 | |
| B. | 甲烷与四氯化碳分子内的键角均为60° | |
| C. | 甲烷分子比四氯化碳稳定,因为C-H键键能比C-Cl键大 | |
| D. | 甲烷沸点低于四氯化碳,因为C-H键键长比C-Cl键短 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ②④⑤ | C. | ①②④ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
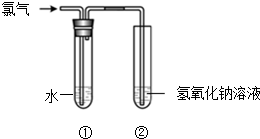 某同学用图所示装置制取氯水并进行相关实验.
某同学用图所示装置制取氯水并进行相关实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
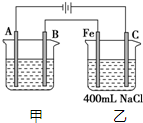 如图所示为相互串联的甲、乙两电解池.试回答:
如图所示为相互串联的甲、乙两电解池.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com