
【题目】香叶醇、橙花醇和乙酸橙花酯在工业上用作香料,它们可由月桂烯来合成。
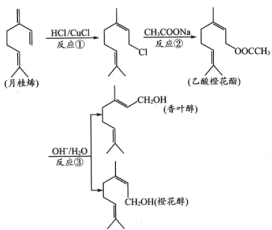
下列说法正确的是
A.反应①②③均为取代反应
B.月桂烯分子中所有碳原子全部处在同一平面上
C.香叶醇和橙花醇具有相同的分子式
D.乙酸橙花酯可以发生取代、加成、氧化和聚合反应
科目:高中化学 来源: 题型:
【题目】I-具有还原性,含碘食盐中的碘元素主要以KIO3的形式存在,I-、I2、IO3-在一定条件下可发生如图转化关系。下列说法不正确的是
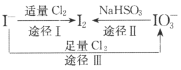
A.用淀粉-KI试纸和食醋可检验食盐是否加碘
B.由图可知氧化性的强弱顺序为C12>IO3->I2
C.生产等量的碘,途径I和途径Ⅱ转移电子数目之比为2:5
D.途径Ⅲ反应的离子方程式:3C12+I-+3H2O=6C1-+IO3-+6H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见的太阳能电池有单晶硅太阳能电池、多晶硅太阳能电池、GaAs 太阳能电池及铜铟镓硒薄膜太阳能电池等。
(1)基态亚铜离子(Cu+)的价电子排布图为_________;高温下CuO 容易转化为Cu2O,试从原子结构角度解释原因:_____。
(2)镓、砷、硒三种元素位于第四周期,其第一电离能从大到小的顺序为_____(用元素符号表示)
(3)GaCl3和AsF3的立体构型分别是_____,_____。
(4)硼酸(H3BO3)本身不能电离出H+,在水中易结合一个OH-生成[B(OH)4]-,而体现弱酸性。
①[B(OH) 4]-中B 原子的杂化类型为_____。②[B(OH)4 ]-的结构式为_____。
(5)金刚石的晶胞如图,若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅;若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原子交替,即得到碳化硅晶体(金刚砂)。

①金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是_____(用化学式表示);②金刚石的晶胞参数为a pm(1pm=10-12 m)。1cm3晶体的平均质量为_____g(只要求列算式,阿伏加德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】公元八世纪,Jabir ibn Hayyan在干馏硝石的过程中首次发现并制得硝酸(4KNO3![]() 2K2O+4NO↑+3O2↑),同时他也是硫酸和王水的发现者。下列说法正确的是
2K2O+4NO↑+3O2↑),同时他也是硫酸和王水的发现者。下列说法正确的是
A. 干馏产生的混合气体理论上可被水完全吸收
B. 王水是由3体积浓硝酸与1体积浓盐酸配制而成的
C. 王水溶解金时,其中的盐酸作氧化剂(Au+HNO3+4HCl=H[AuCl4]+NO↑+2H2O)
D. 实验室可用NaNO3与浓硫酸反应制备少量的HNO3,利用的是浓硫酸的氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A是周期表中原子半径最小的元素,B元素的最高价氧化物的水化物与其氢化物能相互反应生成盐,C元素原子的最外层电子数是其内层电子数的3倍,D元素的主族序数等于其周期数,E元素原子的最外层电子数是其电子层数的2倍,G单质是日常生活中用量最大的金属,易被腐蚀,试回答下列问题:
![]() 元素的同位素有 ______
元素的同位素有 ______ ![]() 写原子符号
写原子符号![]()
![]() 实验室中制取B的简单氢化物的化学反应方程式 ______
实验室中制取B的简单氢化物的化学反应方程式 ______
![]() 、D、E的简单离子半径由大到小的顺序是 ______
、D、E的简单离子半径由大到小的顺序是 ______ ![]() 用离子符号表示
用离子符号表示![]() ,请用化学事实说明C与E这两种元素非金属性的强弱 ______
,请用化学事实说明C与E这两种元素非金属性的强弱 ______ ![]() 举一例
举一例![]()
![]() 向NaOH溶液中通入一定量的F单质,两者恰好完全反应,生成物中有三种含F元素的离子,其中两种离子的物质的量
向NaOH溶液中通入一定量的F单质,两者恰好完全反应,生成物中有三种含F元素的离子,其中两种离子的物质的量![]() 与反应时间
与反应时间![]() 的曲线如图所示,请写出
的曲线如图所示,请写出![]() 时反应的化学方程式 ______
时反应的化学方程式 ______

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学设计实验制备CuBr(白色结晶性粉末,微溶于水,不溶于乙醇等有机溶剂),实验装置(夹持、加热仪器略)如图所示。
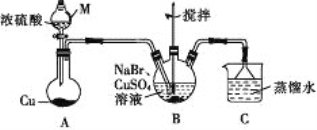
(1)若将M中的浓硫酸换成70%的H2SO4,则圆底烧瓶中的固体试剂为____(填化学式)。
(2)B中发生反应的化学方程式为_____,能说明B中反应已完成的依据是_____。若B中Cu2+仍未完全被还原,适宜加入的试剂是____(填标号)。
A.液溴 B.Na2SO4 C.铁粉 D.Na2S2O3
(3)下列关于过滤的叙述不正确的是___(填标号)。
a.漏斗末端颈尖可以不紧靠烧杯壁 b.将滤纸润湿,使其紧贴漏斗内壁
c.滤纸边缘可以高出漏斗口 d.用玻璃棒在漏斗中轻轻搅动以加快过滤速率
(4)洗涤时,先用装置C中的吸收液清洗,其目的是______,再依次用溶解SO2的乙醇、乙醚洗涤的目的是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ba(NO3)2可用于生产烟花。某主要生产BaCl2、BaCO3、BaSO4的化工厂利用某种钡泥[主要含有BaCO3、Ba(FeO2)2、极少量CuCO3等]制取Ba(NO3)2晶体,其部分工艺流程如下:

已知:Fe3+和Fe2+以氢氧化物形式沉淀完全时,溶液的pH分别为3.2和9.7。
(1)酸溶时不使用浓硝酸的原因是________。
(2)酸溶后溶液中pH=1,Ba(FeO2)2与HNO3的反应化学方程式为___________。
(3)该厂结合本厂实际,中和选用的X为____________(填化学式);中和使溶液中________(填离子符号)的浓度减少(中和引起的溶液体积变化可忽略)。
(4)滤液得到Ba(NO3)2晶体的操作依次为_____________、_____________、过滤。
(5)为了减少环境污染,请对上述流程中不合理的设计进行改进,改进措施是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将红热的固体单质甲放入显黄色的浓乙溶液中,剧烈反应,产生混合气体A,A在常温下不与空气作用,发生如图所示的变化。
气体A![]()
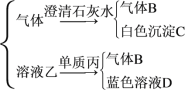
(1)写出下列物质的化学式:丙__,B___,C___,D___。
(2)写出甲跟乙反应的化学方程式:__。
(3)单质丙与溶液乙反应生成气体B的离子方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是
2Na2CO3+C。下列说法错误的是

A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e =2CO32-+C
D. 充电时,正极反应为:Na++e=Na
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com