
下列说法正确的是( )
A.自发反应的熵一定增大,非自发反应的熵一定减小
B.凡是放热反应都是自发的,因为吸热反应都是非自发的
C.反应2Mg(s)+CO2(g)===C(s)+2MgO(s)能自发进行,则该反应的ΔH>0
D.常温下,反应C(s)+CO2(g)  2CO(g)不能自发进行,则该反应的ΔH>0
2CO(g)不能自发进行,则该反应的ΔH>0
科目:高中化学 来源: 题型:
利用右图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产。下列说法
中正确的是( )
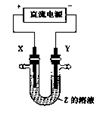
A.氯碱 工业中,X、Y均为石墨,X附近能得到氢氧化钠
工业中,X、Y均为石墨,X附近能得到氢氧化钠
B.铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4
C.电镀工业中,X是待镀金属,Y是镀层金属
D.外加电流的阴极保护法中,Y是待保护金属
查看答案和解析>>
科目:高中化学 来源: 题型:
碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题。
(1)消除汽车尾气中的NO、CO,有利于减少PM2.5的排放。已知如下信息:
I.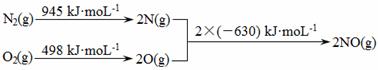
II.N2(g)+ O2(g)  2NO(g) ΔH1
2NO(g) ΔH1
2CO(g) + O2(g) 2CO2 (g) ΔH2= -565 kJ·mol-1
2CO2 (g) ΔH2= -565 kJ·mol-1
①ΔH1= 。
②在催化剂作用下NO和CO转化为无毒气体,写出反应的热化学方程式
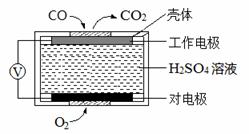 (2)电化学气敏传感器法测定汽车尾气。其中CO传感器的工作原理如右图所示,则工作电极的反应式为
(2)电化学气敏传感器法测定汽车尾气。其中CO传感器的工作原理如右图所示,则工作电极的反应式为
(3)工业上可以用NaOH溶液或氨水吸收过量的SO2,分别生成NaHSO3、NH4HSO3,其水溶液均呈酸性。相同条件下,同浓度的两种酸式盐的水溶液中c(SO32-)较小的是 ,用文字和化学用语解释原因
。
(2)T℃时,在 2L恒容密闭容器中,加入Fe3O4、CO各1.0 mol ,10 min反应达到平衡时,容器中CO2的浓度是0.4 mol /L。
①能证明该反应达到化学平衡的是 (选填字母)。
a.容器内压强不再变化 b.容器内CO、CO2物质的量比为1 : 1
c.容器内气体的质量不再变化 d.生成CO2的速率与消耗CO的速率相等
②l0 min内,反应的平均反应速率v (CO2)= 。
③T℃时,该反应的平衡常数K= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学实验中常将某些溶液或试剂进行酸化或碱化。下列处理中正确的是
( )
A.检验KClO3中的氯元素,可加入AgNO3和稀硝酸
B.为提高KMnO4溶液的氧化能力,用浓盐酸将KMnO4溶液酸化
C.检验蔗糖在稀硫酸中水解产生的葡萄糖,应先用NaOH溶液碱化后才能进一步检验
D.检验溶液中是否含有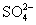 时,先加氯化钡溶液后,再加稀盐酸酸化
时,先加氯化钡溶液后,再加稀盐酸酸化
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学实验事实及其解释或结论都正确的是( )
A.取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+
B.向1 mL 1%的NaOH溶液中加入2 mL 2%的CuSO4溶液,振荡后再加入0.5 mL有机物X,加热后未出现红色沉淀,说明X中不含有醛基
C.向CuSO4溶液中加入KI溶液,有白色沉淀生成,再加入四氯化碳振荡,四氯化碳层呈紫色,说明白色沉淀可能为CuI
D.向浓度均为0.1 mol·L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,首先生成蓝色沉淀,说明Ksp[Cu(OH)2]>Ksp[Mg(OH)2]
查看答案和解析>>
科目:高中化学 来源: 题型:
在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)  Ni(CO)4(g),已知该反应平衡常数与温度的关系如下:
Ni(CO)4(g),已知该反应平衡常数与温度的关系如下:
| 温度/℃ | 25 | 80 | 230 |
| 平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法不正确的是( )
A.上述生成Ni(CO)4(g)的反应为放热反应
B.25 ℃时反应Ni(CO)4(g)  Ni(s)+4CO(g)的平衡常数为2×10-5
Ni(s)+4CO(g)的平衡常数为2×10-5
C.在80 ℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5 mol/L,则此时v(正)>v(逆)
D.80 ℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
向一体积不变的密闭容器中加入2 mol A、0.6 mol C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如图1所示。图2为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知t3~t4阶段为使用催化剂;图1中t0~t1阶段c(B)未画出。

(1)若t1=15 min,则t0~t1阶段以C浓度变化表示的反应速率为v(C)=_______。
(2)t4~t5阶段改变的条件为________,B的起始物质的量为________。各阶段平衡时对应的平衡常数如下表所示:
| t1~t2 | t2~t3 | t3~t4 | t4~t5 | t5~t6 |
| K1 | K2 | K3 | K4 | K5 |
则K1=________(保留两位小数),K1、K2、K3、K4、K5之间的关系为________________(用“>”“<”或“=”连接)。
(3)t5~t6阶段保持容器内温度不变,若A的物质的量共变化了0.01 mol,而此过程中容器与外界的热交换总量为a kJ,写出此温度下该反应的热化学方程式:________________________________________________________________________
________________________________________________________________________。
(4)在相同条件下,若起始时容器中加入a mol A、b mol B和c mol C,达到平衡时体系中各物质的量与t1时刻相等,a、b、c要满足的条件为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在有机合成中,常要将官能团消除或增加,且要求过程科学、简捷,下列相关过程不合理的是( )
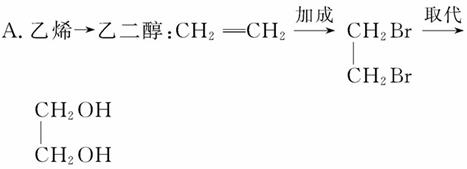
B.溴乙烷→乙醇:CH3CH2Br CH2CH2
CH2CH2  CH3CH2OH
CH3CH2OH
C.乙醛→乙烯:CH3CHO CH3CH2OH
CH3CH2OH CH2=CH2
CH2=CH2
D.乙醇→乙酸:CH3CH2OH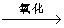 CH3CHO
CH3CHO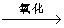 CH3COOH
CH3COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
.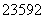 U和
U和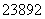 U是铀的两种主要的同位素。
U是铀的两种主要的同位素。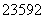 U是制造原子弹和核反应堆的主要原料。下列有关说法正确的是
U是制造原子弹和核反应堆的主要原料。下列有关说法正确的是
A.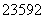 U原子核中含有92个中子
U原子核中含有92个中子
B.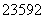 U原子核外有143个电子
U原子核外有143个电子
C.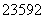 U与
U与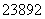 U互为同位素
U互为同位素
D.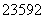 U与
U与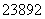 U互为同素异形体
U互为同素异形体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com