



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 �¹�����˹��˾�ɹ����������ü״�����������ȼ�ϵ�ع��գ���ԭ����ͼ1��ʾ����۲��ͼ�ش�
�¹�����˹��˾�ɹ����������ü״�����������ȼ�ϵ�ع��գ���ԭ����ͼ1��ʾ����۲��ͼ�ش��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ���� |
| �¶�/�� | 400 | 500 | 830 | 1000 |
| ƽ�ⳣ��K | 10 | 9 | 1 | 0.6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �¶�/�� | 400 | 500 | 830 | 1000 |
| ƽ�ⳣ��K | 10 | 9 | 1 | 0.6 |
| ʵ���� | n��CO�� | n��H2O�� | n��H2�� | n��CO2�� |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 3 | 3 | 0 | 0 |
| D | 0.5 | 2 | 1 | 1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��7�֣��¹�����˹��˾�ɹ����������ü״�����������ȼ�ϵ�ع��գ���ԭ������ͼ��ʾ����۲��ͼ�ش�
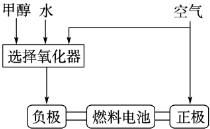
��1���״����ӽ���Ĥȼ�ϵ���н��״�����ת��Ϊ���������ַ�Ӧԭ����
��CH3OH��g��+H2O��g��=CO2��g��+3H2��g������H=+ 49��0 kJ��mol��1
��2CH3OH��g��+O2��g��=2CO2��g��+4H2��g������H=��385.8kJ��mol��1
����˵����ȷ����
A����Ӧ���з�Ӧ��������������������������
B����Ӧ���в�CH3OH��g����H2O��g���еĻ�ѧ���������������γ�CO2��g����3H2��g�� �еĻ�ѧ�����ͷŵ�����
C��CH3OH������ȼ����Ϊ����192��9 kJ��mol��1
D�����ݢ���֪��Ӧ��2CH3OH��l��+ O2��g��=2CO2��g��+4H2��g���ġ�H����385��8kJ��mol��1
��2�������ѧ���������ɫ���ɡ����룺�ѿ�������̼�����Һ��Ȼ���ٰ�CO2����Һ����ȡ����������ѧ��Ӧ��ʹ�����е�CO2ת��Ϊ������ȼ�ϼ״�������2.2kg CO2������H2ǡ����ȫ��Ӧ��������̬��ˮ�ͼ״����ɷų�2473.5 kJ����������д���ϳ����з�����Ӧ���Ȼ�ѧ����ʽ ��
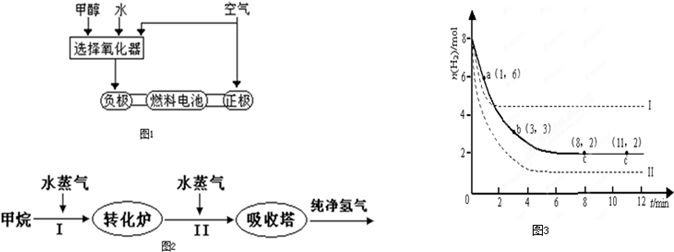
��3���ɸ��ʼDZ����Թ���ļ״�ȼ�ϵ���Ѿ���������ṹʾ��ͼ����ͼ���״��ڴ����������ṩ���ӣ�H�����͵��ӣ����Ӿ����·�����Ӿ��ڵ�·������һ�缫����������Ӧ������ܷ�ӦΪ��2CH3OH��3O2=2CO2��4H2O��b��ͨ��������� ��������ӦΪ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010�걱���и߶��ڶ�ѧ����ĩ���Ի�ѧ�Ծ� ���ͣ������
��7�֣��¹�����˹��˾�ɹ����������ü״�����������ȼ�ϵ�ع��գ���ԭ������ͼ��ʾ����۲��ͼ�ش�

��1���״����ӽ���Ĥȼ�ϵ���н��״�����ת��Ϊ���������ַ�Ӧԭ����
��CH3OH��g��+H2O��g��=CO2��g��+3H2��g������H= + 49��0 kJ��mol��1
��2CH3OH��g��+O2��g��=2CO2��g��+4H2��g������H=��385.8kJ��mol��1
����˵����ȷ����
A����Ӧ���з�Ӧ��������������������������
B����Ӧ���в�CH3OH��g����H2O��g���еĻ�ѧ���������������γ�CO2��g����3H2��g�� �еĻ�ѧ�����ͷŵ�����
C��CH3OH������ȼ����Ϊ����192��9 kJ��mol��1
D�����ݢ���֪��Ӧ��2CH3OH��l��+ O2��g��=2CO2��g��+4H2��g���ġ�H����385��8kJ��mol��1
��2�������ѧ���������ɫ���ɡ����룺�ѿ�������̼�����Һ��Ȼ���ٰ�CO2����Һ����ȡ����������ѧ��Ӧ��ʹ�����е�CO2ת��Ϊ������ȼ�ϼ״�������2.2kg CO2������H2ǡ����ȫ��Ӧ��������̬��ˮ�ͼ״����ɷų�2473.5 kJ����������д���ϳ����з�����Ӧ���Ȼ�ѧ����ʽ ��
��3���ɸ��ʼDZ����Թ���ļ״�ȼ�ϵ���Ѿ���������ṹʾ��ͼ����ͼ���״��ڴ����������ṩ���ӣ�H�����͵��ӣ����Ӿ����·�����Ӿ��ڵ�·������һ�缫����������Ӧ������ܷ�ӦΪ��2CH3OH��3O2=2CO2��4H2O��b��ͨ��������� ��������ӦΪ�� ��

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com