
| 晶体 | NaCl | KCl | CaO |
| 晶格能/(kJ?mol-1) | 786 | 715 | 3 401 |


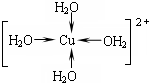 ,故答案为:
,故答案为: ;
;| 6+2-2×4 |
| 2 |


科目:高中化学 来源: 题型:
A、实验室可采用如图所示装置制取氨气 |
| B、用分液漏斗从石油里分离出汽油、煤油和石蜡 |
| C、用浓硝酸与蛋白质的颜色反应鉴别部分蛋白质 |
| D、用碱式滴定管盛装KMnO4溶液滴定FeSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④⑤ | B、①③④⑤⑥ |
| C、②③⑤⑥ | D、③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
A、NH
| ||||
B、K+、Na-、ClO-、SO
| ||||
| C、Fe3+、Na-、Cl-、SCN- | ||||
D、K+、Al3+、NO
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+Fe(OH)3=FeO42-+3Cl-+H2O+4H+ | ||||
| B、用Na2O2与H2O反应制备O2:Na2O2+H2O=2Na++2OH-+O2↑ | ||||
| C、向Fe(NO3)2溶液中加入过量的HI溶液 3Fe2++NO-3+4H+=3Fe3++NO↑+2H2O | ||||
D、用铁棒作阴极、炭棒作阳极电解饱和氯化钠溶液:2Cl-+2H2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、ZnO |
| B、K2CO3 |
| C、KOH |
| D、CuO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com