
| A. | 均加倍 | B. | 加入1mol C | C. | 均增加1mol | D. | 均减半 |
分析 某温度下,在一体积固定的密闭容器中,反应2A(g)+B(g)═2C(g),达到平衡时,A、B、C的物质的量分别为4mol、2mol、4mol.依据平衡常数概念和化学方程式计算得到该温度下反应的平衡常数,设体积为1L,则K=$\frac{4{\;}^{2}}{4{\;}^{2}×2}$=0.5,改变条件依据平衡常数概念分别计算浓度商和平衡常数比较分析判断反应进行的方向,据此分析解答.
解答 解:某温度下,在一体积固定的密闭容器中,反应2A(g)+B(g)═2C(g),达到平衡时,A、B、C的物质的量分别为4mol、2mol、4mol.依据平衡常数概念和化学方程式计算得到该温度下反应的平衡常数,设气体体积为1L,则K=$\frac{4{\;}^{2}}{4{\;}^{2}×2}$=0.5;
A、设气体体积为1L,均加倍 Q=$\frac{8{\;}^{2}}{8{\;}^{2}×4}$=0.25<K=0.5,反应正向进行,所以A的转化率增大,故A错误;
B、设气体体积为1L,加入1molC,Q=$\frac{5{\;}^{2}}{4{\;}^{2}×2}$=0.78>K=0.5,平衡逆向进行,所以A的转化率减小,故B正确;
C、设气体体积为1L,均增加1mol,Q=$\frac{5{\;}^{2}}{5{\;}^{2}×3}$=$\frac{1}{3}$<K=0.5,反应正向进行,所以A的转化率增大,故C错误;
D、设气体体积为1L,均减半,Q=$\frac{2{\;}^{2}}{2{\;}^{2}×1}$=1>K=0.5,平衡逆向进行,所以A的转化率减小,故D正确;
故选:BD.
点评 本题考查化学平衡移动,要注意的是基本概念、基础理论是高考中不变的一个重点.这道题的设问别具一格,解答时既要定性判断、又要定量分析,多次灵活转换,都值得大家研究,思维转化是解答该题的关键.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | R | W | X | Y | Z |  |
| A | Si | SiO2 | H2SiO3 | Na2SiO3 | SiCl4 | |
| B | Na | Na2O | Na2O2 | Na2CO3 | NaOH | |
| C | Fe | Fe(OH)2 | FeCl2 | FeCl3 | Fe(NO3)3 | |
| D | Al | NaAlO2 | Al2(SO4)3 | AlCl3 | Al(NO3)3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
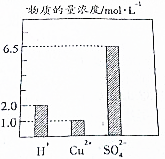 在0.2L由H2SO4、CuSO4和Al2(SO4)组成的混合液中,部分离子浓度大小如图所示,回答下列问题:
在0.2L由H2SO4、CuSO4和Al2(SO4)组成的混合液中,部分离子浓度大小如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28g CO和16g O2所含的原子数都为2NA | |
| B. | 300mL 2mol/L乙醇水溶液中所含H原子数为3.6NA | |
| C. | 标准状况下,22.4L CO2和O2的混合气体含有的分子总数为NA | |
| D. | 5.6g Fe与足量Cl2反应时转移电子总数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgCl沉淀生成和沉淀溶解不断进行,但速率相等 | |
| B. | AgCl难溶于水,溶液中没有Ag+和Cl- | |
| C. | 在AgCl沉淀溶解平衡体系中加入蒸馏水,AgCl的Ksp增大 | |
| D. | AgCl在相同浓度的CaCl2和NaCl溶液中的溶解度相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com