
 甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:分析 (1)根据盖斯定律,由已知方程式构建目标方程式可得到CH4与O2反应生成CO和H2的热化学反应方程式;
(2)①II中实现镀铜,则Cu作阳极、Fe作阴极,I中a处电极为负极、b处电极为正极,负极上通入燃料、正极上通入氧化剂;甲烷失电子和氢氧根离子反应生成碳酸根离子和水;
②根据I中氢氧根离子浓度变化确定溶液pH变化;II中发生电镀,阳极上Cu溶解;
③I是原电池装置,装置Ⅱ中Fe作阴极;
④根据转移电子相等计算消耗甲烷的体积.
解答 解:(1)①CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=+260kJ/mol
②2CO(g)+O2(g)═2CO2(g)△H=-566kJ/mol
根据盖斯定律,由①×2+②得:2CH4(g)+O2(g)═2CO(g)+4H2(g)△H=-46 kJ/mol,
故答案为:2CH4(g)+O2(g)═2CO(g)+4H2(g)△H=-46 kJ/mol;
(2)①II中实现镀铜,则Cu作阳极、Fe作阴极,I中a处电极为负极、b处电极为正极,负极上通入燃料、正极上通入氧化剂氧气,正极电极反应为O2+2H2O+4e-═4OH-,
故答案为:O2+2H2O+4e-═4OH-;
②根据I中电池反应为CH4+2O2+2KOH=K2CO3+3H2O,KOH参加反应导致溶液中KOH浓度降低,则溶液的pH减小;
故答案为:变小;
③装置Ⅰ的能量转变形式是化学能转化为电能,装置Ⅱ中Fe电极是阴极,该电极上发生还原反应,故答案为:化学能转化为电能;还原;
④串联电路中转移电子相等,所以消耗甲烷的体积=$\frac{\frac{12.8g}{64g/mol}×2}{8}$×22.4L/mol=1.12L,故答案为:1.12.
点评 本题考查了盖斯定律、原电池和电解池原理,根据电解池中Cu、Fe电极上发生的反应确定燃料电池中正负极及电极上通入的气体,再结合转移电子相等计算,难点是电极反应式的书写.


科目:高中化学 来源: 题型:选择题
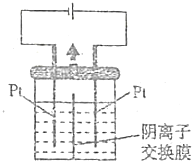 以Pt为电极电解淀粉KI溶液的装置如图所示,中间用阴离子交换膜(只允许阴离子通过)将电解槽隔开,则下列观点正确的是( )
以Pt为电极电解淀粉KI溶液的装置如图所示,中间用阴离子交换膜(只允许阴离子通过)将电解槽隔开,则下列观点正确的是( )| A. | 电解过程中左侧发生的电极反应式:40H--4e-═2H2O+O2↑ | |
| B. | 电解过程中左侧溶液中的0H-通过离子交换膜向右侧溶液移动 | |
| C. | 电解一段时间后左、右两侧溶液中的K+的物质的量浓度不变 | |
| D. | 电解初期,右侧溶液能变蓝色,继续电解,溶液的蓝色一定加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
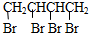
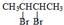 +2NaOH$→_{△}^{乙醇}$CH2=CHCH=CH2↑+2NaBr+2H2O
+2NaOH$→_{△}^{乙醇}$CH2=CHCH=CH2↑+2NaBr+2H2O| A | B | C | |
| 加入氯化铁溶液 | 显紫色 | 无明显现象 | 无明显现象 |
| 加入钠 | 放出氢气 | 放出氢气 | 不反应 |
| 苯环上一氯代物的种数 | 2 | 3 | 3 |
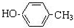 B
B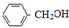 C
C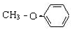
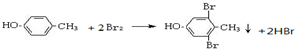
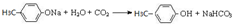
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 | B. | 6 | C. | 8 | D. | 12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用食醋除去水垢:${CO}_{3}^{2-}$+2CH3COOH═2CH3COO-+CO2↑+H2O | |
| B. | 用惰性电解电解氯化镁溶液:Mg2++2Cl-$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑ | |
| C. | 钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-═Fe3- | |
| D. | 碳酸氢钠溶液显碱性:${HCO}_{3}^{-}$+H2O?H2CO3+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫 | B. | 二氧化硅 | C. | 铁 | D. | 氧化铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com