
分析 (1)热化学方程式中△H为负值的反应为放热反应,△H为正值的为吸热反应;
(2)1mol纯净物完全燃烧生成稳定的氧化物所放出的热量为燃烧热;
(3)燃烧10g H2生成液态水,依据热化学方程式①计算;
(4)根据已知的热化学方程式结合盖斯定律计算;
(5)依据题干信息结合元素守恒计算有机物,依据热化学方程式书写方法标注物质聚集状态和反应焓变写出.
解答 解:(1)热化学方程式中△H为负值的反应为放热反应,△H为正值的为吸热反应,
①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285kJ/mol
②H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ/mol
③C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.4kJ/mol
④C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol
以上4个反应①②③④为放热反应,故答案为:①②③④;
(2)1mol纯净物完全燃烧生成稳定的氧化物所放出的热量为燃烧热,C的燃烧热为393.5kJ/mol,
故答案为:393.5kJ/mol;
(3)依据反应①进行计算燃烧10g H2生成液态水放出的热量;
H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285kJ•mol-1
2g 285kJ
10g Q
Q=$\frac{10g×285kJ}{2g}$=1425kJ,
故答案为:1425 kJ;
(4)③C(s)+$\frac{1}{2}$O2(g)=CO(g);△H=-110.4kJ/mol
④C(s)+O2(g)=CO2(g);△H=-393.5kJ/mol
依据盖斯定律④-③得到CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△=-283.1kJ/mol;
故答案为:CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△=-283.1kJ/mol;
(5)2.3g某液态有机物和一定量的氧气混合点燃,恰好完全燃烧,生成2.7g水物质的量=$\frac{2.7g}{18g/mol}$=0.15mol,2.24L CO2(标准状况)物质的量=$\frac{2.24L}{22.4L/mol}$=0.1mol,n(C)=0.1mol,n(H)=0.3mol,n(O)=$\frac{2.3g-0.1mol×12g/mol-0.3mol×1g/mol}{16g/mol}$=0.05mol,
则n(C):n(H):n(O)=0.1mol:0.3mol:0.05mol=2:6;1,化学式为C2H6O,
物质的量为0.05mol,并放出68.35kJ热量,1mol有机物燃烧放热1367KJ,热化学方程式为:C2H6O(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1367kJ/mol;
故答案为:C2H6O(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1367kJ/mol.
点评 本题考查了放热反应的判断、燃烧热的概念应用、盖斯定律的应用、有机物分子式的确定等,侧重于考查学生的分析能力和计算能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
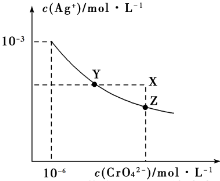
| A. | 在t℃时,Ag2CrO4的Ksp为1×10-12 | |
| B. | 在t℃时,AgCl的溶解度大于Ag2CrO4 | |
| C. | 在饱和Ag2CrO4溶液中加入K2CrO4,可使溶液由Y点到X点 | |
| D. | 在t℃时,用AgNO3标准溶液滴定20mL未知浓度的KCl溶液,不能采用K2CrO4溶液为指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成物的总能量一定低于反应物总能量 | |
| B. | 吸热反应一定要加热条件才能进行 | |
| C. | 同温同压下,H2(g)+Cl2(g)=2HCl(g) 在光照和点燃条件的△H不同 | |
| D. | 用C(s)和CO(g)的燃烧热数据,可以计算化学反应C(s)+$\frac{1}{2}$O2(g)=CO(g)的焓变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,C
,C ,D
,D .
.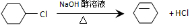 ;
; ;
; .
. +2CH3COOH$?_{△}^{浓硫酸}$
+2CH3COOH$?_{△}^{浓硫酸}$ +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 金属铝溶于氢氧化钠溶液:Al+2OH-=AlO2-+H2↑ | |
| C. | 向Al2(SO4)3溶液中加入过量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 少量SO2通入漂白粉溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.右图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.右图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以用澄清石灰水鉴别SO2和CO2 | |
| B. | 硫粉在过量的纯氧中燃烧可以生成SO3 | |
| C. | SO2能使溴水、酸性KMnO4溶液褪色 | |
| D. | 少量SO2通过浓的氯化钙溶液能生成白色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com