

分析 (1)铁比铜活泼,为原电池的负极,铁失电子发生氧化反应,铜为正极,溶液中的铜离子在正极得电子发生还原反应;
(2)负极上铁溶解,正极上析出铜,铁片和铜片相差的质量为溶解铁和析出铜的质量之和,溶解铁的物质的量和析出铜的物质的量相等,根据金属和转移电子之间的关系式计算;
(3)①B装置构成原电池,Fe更活泼易失电子作负极,Sn作正极,正极上氢离子得电子发生还原反应而生成氢气,导致氢离子浓度降低;
②作负极的金属加速被腐蚀,作正极的金属被保护,金属腐蚀快慢速率:作负极的金属>发生化学腐蚀的金属>作正极的金属;
(4)①氢氧燃料电池的总反应即是氢气与氧气反应生成水;
②根据燃料电池的总反应方程式判断硫酸浓度的变化.
解答 解:(1)铁比铜活泼,为原电池的负极,发生氧化反应,电极方程式为Fe-2e-=Fe2+;铜为正极,发生还原反应,电极方程式为Cu2++2e-=Cu,则铜片周围溶液会出现溶液颜色变浅的现象,
故答案为:Fe-2e-=Fe2+;溶液颜色变浅;
(2)设转移xmol电子,则消耗0.5xmolFe,析出0.5xmolCu,则有0.5x×(64+56)=1.2,x=0.02,
故答案为:0.02;
(3)①B装置构成原电池,Fe更活泼易失电子作负极,Sn作正极,正极上氢离子得电子发生还原反应而生成氢气,电极反应式为2H++2e-=H2↑,导致氢离子浓度降低,溶液的pH增大,
故答案为:正;增大;
②A装置中Fe发生化学腐蚀;装置B、C构成原电池,B装置中Fe更活泼易失电子作负极,Sn作正极;C装置中Zn易失电子作负极,Fe作正极,作负极的金属加速被腐蚀,所以锌被腐蚀,作正极的金属铁被保护,金属腐蚀快慢速率为:作负极的金属>发生化学腐蚀的金属>作正极的金属,所以铁被腐蚀快慢速率为B>A>C,
故答案为:锌;B>A>C;
(4)①氢氧燃料电池的总反应即是氢气与氧气反应生成水,其反应的总方程式为:2H2+O2=2H2O,
故答案为:2H2+O2=2H2O;
②已知氢氧燃料电池的总反应为:2H2+O2=2H2O,电池工作一段时间后,生成水使溶液体积增大,则硫酸的浓度减小,
故答案为:减小.
点评 本题考查原电池的工作原理,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握原电池的工作原理,把握电极方程式的书写,难度不大.


科目:高中化学 来源: 题型:选择题
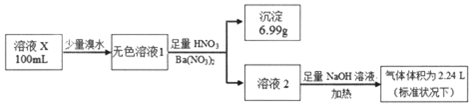
| A. | 溶液X肯定只存在NH4+、SO42- | |
| B. | 溶液X一定不含有Ba2+、Fe3+,可能含有I- | |
| C. | 为确定可能存在的阴离子,可另取试液滴加足量盐酸、BaCl2溶液 | |
| D. | 为确定可能存在的阳离子,可用经过稀硫酸洗过的铂丝蘸取溶液X在酒精灯火焰上灼烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铜跟浓HNO3反应:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| B. | 向氯化铝溶液中加入过量氨水:Al3++3OH-═AlO2-+2H2O | |
| C. | 向水通入中NO2:3NO2+H2O═2H++2NO3-+NO | |
| D. | NH4Cl溶液和AgNO3溶液混合:NH4Cl+Ag +═Ag Cl↓+NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
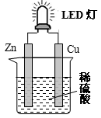
| A. | 铜是负极,电子从铜片经导线流向锌片 | |
| B. | 大多数氢离子在锌片上获得电子被还原 | |
| C. | 装置中存在“化学能→电能→光能”的转换 | |
| D. | 如果将硫酸换成西红柿汁,导线中不会有电子流动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②③④ | C. | ①②③④⑤ | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述热化学方程式说明反应物的总键能大于生成物的总键能 | |
| B. | 达平衡后再通入NH3,则平衡正向移动,NH3转化率减小 | |
| C. | 达平衡后升温,则逆反应速率加快,正反应速率减慢,平衡逆向移动 | |
| D. | 达平衡后加入催化剂能同时增大正逆反应速率,平衡发生移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 有机物A的结构简式为
有机物A的结构简式为 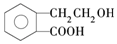 ,它可通过不同化学反应分别制得B、C、D和E四种物质.
,它可通过不同化学反应分别制得B、C、D和E四种物质.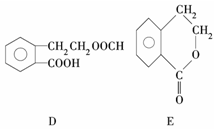
 .
. .
. +2NaOH→
+2NaOH→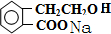 +HCOONa+H2O.
+HCOONa+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com