
有西方学者认为:“近代世界赖以建立的种种发明与发现可能有一半来源于中国”。传入欧洲并对“近代世界”的到来产生了重大影响的中国科技成就是( )
A.地动仪 B.造纸术 C.雕版印刷术 D.罗盘针
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:阅读理解
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
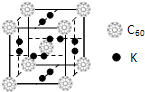
查看答案和解析>>
科目:高中化学 来源: 题型:
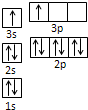
 (1)下列是部分金属元素的电离能
(1)下列是部分金属元素的电离能| X | Y | Z | |
| 第一电离能(kJ/mol) | 520.2 | 495.8 | 418.8 |
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
查看答案和解析>>
科目:高中化学 来源: 题型:
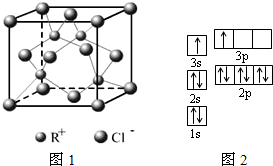
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
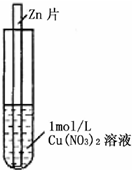 (2011?上饶二模)如图,将一锌片放入1mol?L-1蓝色Cu(NO3)2溶液中,观察到下列实验现象:①反应初期锌片上有大量气泡冒出,同时液面的上一层Cu(NO3)2溶液开始呈现绿色,并且逐渐向液面下的深处扩散,试管底部有红色固体出现.②与锌片接触的溶液温度明显升高,反应越来越剧烈,并在红色固体上方开始出现一层蓝色沉淀,并逐渐增多.③反应后期溶液逐渐变为无色,试管底部又有部分白色沉淀物.
(2011?上饶二模)如图,将一锌片放入1mol?L-1蓝色Cu(NO3)2溶液中,观察到下列实验现象:①反应初期锌片上有大量气泡冒出,同时液面的上一层Cu(NO3)2溶液开始呈现绿色,并且逐渐向液面下的深处扩散,试管底部有红色固体出现.②与锌片接触的溶液温度明显升高,反应越来越剧烈,并在红色固体上方开始出现一层蓝色沉淀,并逐渐增多.③反应后期溶液逐渐变为无色,试管底部又有部分白色沉淀物.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com