
����Ŀ����ͼ��ijѧУʵ���Ҵӻ�ѧ�Լ��̵���ص�Ũ�����Լ���ǩ�ϵIJ������ݣ�
�����ø�Ũ�������Ƴ�1mol/L��ϡ���ᣮ
��ʵ���ҽ���Ҫ����ϡ����220mL���Իش���������
��1������Ͳ��ȡ��Ũ����mL��
��2������ʱ������ʹ�õ���������Ͳ���ձ����������⣬��ȱ�ٵ���������
��3��������Һ�Ĺ����У�������������ȷ�����в�����ʹ������ҺŨ
��ƫ�ߵ�����
A.����Ͳ��ȡŨ����ʱ����
B.ϡ��Ũ����ʱ��δ��ȴ�����¼�ת�Ƶ�����ƿ��
C.��ȡŨH2SO4�����Ͳ����ϴ�ӣ�����ϴ��Һת�Ƶ�����ƿ��
D.����ҡ�Ⱥ���Һ����ڿ̶��ߣ����ý�ͷ�ιܼ�����ˮ����Һ����ʹ���̶�������
E.����ƿ������
F.����ʱ����������ƿ�̶���
��4����������0.1mol/LNaOH��Һ450mL��
�ٸ��ݼ����֪������NaOH������Ϊg��
������ʱ������ȷ�IJ���˳���ǣ�����ĸ��ʾ��ÿ����ĸֻ����һ�Σ� ��
A����30mLˮϴ���ձ�2��3�Σ�ϴ��Һ��ע������ƿ
B��ȷ��ȡ���������������ƹ������ձ��У��ټ�������ˮ��Լ30mL�����ò���������������ʹ�����ܽ�
C�����ܽ������������Һ�ز�����ע��500mL������ƿ��
D��������ƿ�ǽ�����ҡ��
E�����ý�ͷ�ιܼ�ˮ��ʹ��Һ����ǡ����̶�����
F������������ƿ��С�ļ�ˮ��ֱ��Һ��ӽ��̶�1��2cm����
���𰸡�
��1��13.6
��2��250mL����ƿ����ͷ�ι�
��3��B,C,F
��4��2.0,BCAFED
���������⣺��1����ʵ���ҽ���Ҫ1mol/L��ϡ����220mL��Ӧ��ѡ�ù��Ϊ250mL������ƿ��������250mL 1mol/L��ϡ���ᣬ����Ҫ��Ũ��������ΪxmL�����ƹ�����������������䣬��98g/mol��1mol/L��0.25L=xmL��1.84g/cm3��98%����ã�x��13.6��
���Դ��ǣ�13.6��
��2�����Ʋ����м��㡢��ȡ��ϡ�͡���ȴ����Һ��ϴ����Һ�����ݡ�ҡ�ȵȲ�����һ������Ͳ��ȡ���õ���ͷ�ιܣ������ձ���ϡ�ͣ����ò��������裬��ȴ��ת�Ƶ�250mL����ƿ�У����ò���������������ˮ��Һ�����̶���1��2cmʱ�����ý�ͷ�ιܵμӣ��μ�����Һ������̶���ˮƽ���У��Ǻ�ƿ����ҡ�ȣ�������Ҫ������Ϊ����Ͳ���ձ�����������250mL����ƿ����ͷ�ιܣ���ȱ��250mL����ƿ����ͷ�ιܣ�
���Դ��ǣ�250mL����ƿ����ͷ�ιܣ�
��3��A����ȡŨ����ʱ�����Ӷ�����������ȡ��Ũ�������ƫС�����Ƶ���Һ�����ʵ����ʵ���ƫС����ҺŨ��ƫ�ͣ���A����
B��ϡ��Ũ����ʱ��δ��ȴ�����¼�ת�Ƶ�����ƿ�������ȵ���Һ���ƫ����ȴ��������Һ�����С�����Ƶ���Һ���ƫС����ҺŨ��ƫ�ߣ���B��ȷ��
C��ϴ����ȡŨH2SO4�����Ͳ������ϴ��Һת�Ƶ�����ƿ�У��������Ƶ���Һ�����ʵ����ʵ���ƫ����ҺŨ��ƫ�ߣ���C��ȷ��
D������ҡ�Ⱥ���Һ����ڱ��ߣ����ý�ͷ�ιܼ�����ˮ�����ߣ��������Ƶ���Һ���ƫ�����Ƶ���ҺŨ��ƫ�ͣ���D����
E������ƿ��������ڶ��ݻ���Ҫ��������ˮ�����Բ�Ӱ�����ƽ������E����
F������ʱ����������ƿ�̶��ߣ����������ˮ���ƫС�����Ƶ���ҺŨ��ƫ�ߣ���F��ȷ��
���Դ��ǣ�BCF��
��4��������0.1mol/LNaOH��Һ450mL��ʵ�������Ƶ���500mL 0.1mol/L����Һ����ҪNaOH�����ʵ���Ϊ��0.1mol/L��0.5L=0.05mol����Ҫ�������Ƶ�����Ϊ��40g/mol��0.05mol=2.0g��
���Դ��ǣ�2.0��
�ڲ��������м��㡢�������ܽ⡢��Һ��ϴ����Һ�����ݡ�ҡ�ȵȲ�����һ����������ƽ��������ҩ��ȡ��ҩƷ�����ձ����ܽ⣨������Ͳ��ȡˮ�����ձ��������ò��������裬�����ܽ⣮��ȴ��ת�Ƶ�500mL����ƿ�У����ò�����������ϴ���ձ���������2��3�Σ�����ϴ��Һ��������ƿ�У���ˮ��Һ�����̶���1��2cmʱ�����ý�ͷ�ιܵμӣ�����ݵߵ�ҡ�ȣ�������ȷ�IJ���˳��Ϊ��BCAFED��
���Դ��ǣ�BCAFED��
�����㾫�����������⣬������Ҫ�˽�����һ�����ʵ���Ũ�ȵ���Һ(�������ʵ���Ũ����Һʱ�������ձ�������ˮ������ƿ�̶���1cm��2cm���ٸ��ý�Ͷ�ιܼ�ˮ���̶���)��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�������������ַ��������������ú�HCl 146g��Ũ������������MnO2��Ӧ������87gMnO2������Ũ���ᷴӦ�����õ�������������
A.�ٱȢڶ�
B.�ڱȢٶ�
C.һ����
D.���Ƚ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����⻯�ƣ�NaBH4�����������Ļ�ԭ�ԣ����л���ѧ������ѧ�������Ź㷺��Ӧ�ã���������Ҫ�ɷ�ΪB2O3 �� ��������Al2O3��SiO2��FeCl3�ȣ���ȡNaBH4��������ͼ1�� 
��֪��ƫ�����ƣ�NaBO2��������ˮ�������ڴ����ڼ����������ȶ����ڣ��ش��������⣺
��1��д���ӿ����ܽ����ʵĴ�ʩ��дһ�֣���
��2������1Ϊ �� ������Ҫ�ɷ�Ϊ ��
��3���������������CaO��������CaCl2��ԭ���У����ܽ��衢���Գ�����ȥ���� ��
��4���⻯þ��MgH2����HԪ�صĻ��ϼ�Ϊ��MgH2��NaBO2��һ�������·�����Ӧ1���仯ѧ����ʽΪ�� ��
��5����ͼ2�ڼ��������£��������ϵ��NaBO2Ҳ���Ƶ����⻯�ƣ�д�������ҵĵ缫��Ӧʽ ��
��6�����⻯����һ��ǿ��ԭ�������������ɴ�����Ʒ�Һ�е�����ͭ�Ƶ�����ͭ���Ӷ����Ϊ����д���÷�Ӧ�����ӷ���ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ܱ������д�������ƽ�⣺CO��g��+H2O��g��CO2��g��+H2��g����CO2��g����ƽ�����ʵ���Ũ��c��CO2�����¶�T�Ĺ�ϵ��ͼ��ʾ������˵��������ǣ� �� 
A.��T2ʱ������Ӧ���е�״̬D����һ����v����v��
B.ƽ��״̬A��C��ȣ�ƽ��״̬A��c��CO��С
C.��T1��T2ʱ��ƽ�ⳣ���ֱ�ΪK1��K2 �� ��K1��K2
D.��ӦCO��g��+H2O��g��CO2��g��+H2��g���ġ�H��0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ش��������⣺������NA��ʾ����٤��������ֵ��
��1��0.1molAl2��SO4��3�к�����������Ϊ����Al3+�������� �� SO42�������ʵ�������
��2����ijԭ�ӵ�Ħ��������M g/mol����һ����ԭ�ӵ���ʵ������g��
��3������״���µ�aLHCl��g������1000gˮ�У��õ��������ܶ�Ϊbg/mL�������������ʵ���Ũ������
��4������14.4g CO��CO2�Ļ�����壬�ڱ�״���������Ϊ8.96L��
�ٸû�������ƽ��Ħ������Ϊ��
�ڻ��������̼ԭ�ӵĸ���Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ھƾ��ƻ�����ֱ�Ӽ��ȵ�������
A. �Թ� B. ������
C. ȼ�ճ� D. �ձ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����100��ʱ����0.200mol�������������������2L��յ��ܱ������У�ÿ��һ��ʱ��Ը������ڵ����ʽ��з������õ����±���
ʱ�䣨S�� | 0 | 20 | 40 | 60 | 80 | 100 |
n��N2O4�� mol | 0.200 | c1 | 0.10 | c3 | a | b |
n��NO2�� mol | 0.000 | 0.120 | c2 | 0.240 | 0.240 | 0.240 |
����գ�
��1���÷�Ӧ�Ļ�ѧ����ʽΪ ��
��2���ﵽƽ��ʱ������������ת����Ϊ ��
��3��20sʱ������������Ũ��c1=molL��1 ��
��4����0��20sʱ����ڣ�����������ƽ����Ӧ����Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��830Kʱ�����ܱ������з������п��淴Ӧ��CO��g��+H2O��g��CO2��g��+H2��g����H��0
�Իش��������⣺
��1����д���û�ѧ��Ӧ��ƽ�ⳣ������ʽ�� ��
��2��830K�¶��£�����ʼʱc��CO��=2molL��1 �� c��H2O��=3molL��1 �� �ﵽƽ��ʱCO��ת����Ϊ50%�����ڸ��¶��£��÷�Ӧ��ƽ�ⳣ��K= ��
��3���������¶ȣ��÷�Ӧ��Kֵ�� �� �÷�Ӧ������Ӧ���ʽ��� �÷�Ӧ���淴Ӧ���ʽ������������С�����䡱����
��4����Ҫ���CO��ת���ʣ��ɲ�ȡ�Ĵ�ʩ�У� ��
��5��830K�¶��£�����ʼʱc��CO��=1molL��1 �� c��H2O��=2molL��1 �� ��Ӧ����һ��ʱ����H2��Ũ��Ϊ0.5molL��1 �� ���ʱ�÷�Ӧ�Ƿ�ﵽƽ��״̬����ǡ��롰�������жϵ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʾ���Ӧ��������������ǣ� ��
A.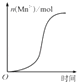
��ʾ10 mL 0.01molL��1KMnO4������Һ�������0.1molL��1 H2C2O4��Һ���ʱ��n��Mn2+����ʱ��ı仯��Mn2+�Ը÷�Ӧ�д����ã�
B.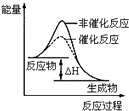
��ʾij���ȷ�Ӧ�ֱ����С�����������·�Ӧ�����е������仯
C.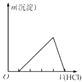
��ʾʾ���������������Ƶ�ƫ��������Һ�еμ��������ó������ʵ�������������Ĺ�ϵ
D.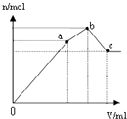
��ʾ��NH4Al��SO4��2��Һ����ε���Ba��OH��2��Һ������Ba��OH��2��Һ���V�ı仯�����������ʵ���n�ı仯
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com