
| A. | Cl2 | B. | HCl | C. | HClO | D. | H2O |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
 CCTV-1《焦点访谈》栏目中曾报道“铊中毒事件”,铊再次成为公众关注的焦点.铊的相关信息如图所示,其中“6s26p1”表示铊原子有6个电子层,最外层有3个电子.下列有关卡片信息解读不正确的是( )
CCTV-1《焦点访谈》栏目中曾报道“铊中毒事件”,铊再次成为公众关注的焦点.铊的相关信息如图所示,其中“6s26p1”表示铊原子有6个电子层,最外层有3个电子.下列有关卡片信息解读不正确的是( )| A. | 铊的元素符号为Tl | B. | 铊原子的中子数=204-81=123 | ||
| C. | 铊位于第六周期ⅢA族 | D. | 铊的金属性比铝的金属性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸、纯碱、偏铝酸钠和过氧化钠分别属于酸、碱、盐和氧化物 | |
| B. | 乙醇、次氯酸钠和二氧化硫分别属于非电解质、强电解质和弱电解质 | |
| C. | Na、Al、Cu通常分别用电解法、热分解法和置换法冶炼得到 | |
| D. | 天然气、沼气和水煤气分别属于化石能源、可再生能源和二次能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学习小组探究NaHCO3、Na2HCO3和盐酸(盐酸浓度均为1mol.L-1)反应过程中的热效应,实验测得如下数据:
某学习小组探究NaHCO3、Na2HCO3和盐酸(盐酸浓度均为1mol.L-1)反应过程中的热效应,实验测得如下数据:| 序号 | 35mL试剂 | 固体 | 混合温度前/℃ | 混合温度后/℃ |
| ① | 水 | 2.5gNaHCO3 | 20.0 | 18.5 |
| ② | 水 | 3.2gNa2CO3 | 20.0 | 24.3 |
| ③ | 盐酸 | 2.5gNaHCO3 | 20.0 | 16.2 |
| ④ | 盐酸 | 3.2gNa2CO3 | 20.0 | 25.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
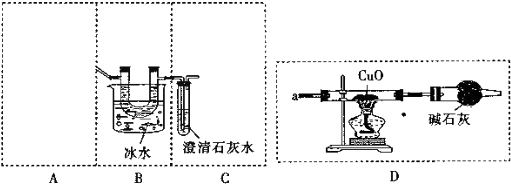
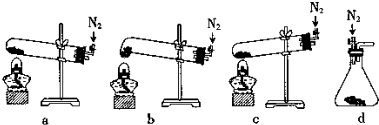
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
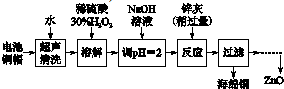
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
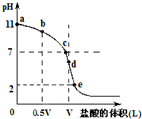 常温时向浓度为0.1mol/L体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应.根据图象回答下列问题:
常温时向浓度为0.1mol/L体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应.根据图象回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com