
 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,氨是最重要的氮肥,是产量最大的化工产品之一.其工业合成原理为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.在密闭容器中,使2mol N2和6mol H2混合发生以上反应.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,氨是最重要的氮肥,是产量最大的化工产品之一.其工业合成原理为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.在密闭容器中,使2mol N2和6mol H2混合发生以上反应.分析 (1)起始的物质的量比等于化学计量数之比,则转化率相同,平衡浓度之比等于化学计量数之比;
(2)为放热反应,升高温度,平衡逆向移动,气体的质量不变,n增大;
(3)充入氩气并保持压强不变,反应体系的压强减小,平衡逆向移动;
(4)为放热反应,若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡逆向移动;
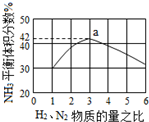
(5)氨气体积含量42%,设平衡混合气体体积为100,氨气为体积42,则反应前气体体积100+42=142,氮气和氢气按照1:3混合,结合反应及差量法计算;
(6)反应平衡时溶液中c(NH4+)=c(Cl-),结合Kb=$\frac{c(O{H}^{-})c(N{{H}_{4}}^{+})}{c(N{H}_{3}.{H}_{2}O)}$计算.
解答 解:(1)在密闭容器中,使2molN2和6molH2混合发生下列反应:N2(g)+3H2(g)?2NH3(g),反应物起始量之比等于化学方程式中的反应之比,所以平衡浓度为1:3,N2和H2的转化率比是为1:1,
故答案为:1:3;1:1;
(2)N2(g)+3H2(g)?2NH3(g),反应是放热反应,升温平衡逆向进行,气体质量不变,气体物质的量增大,根据容器中气体的平均相对分子量=$\frac{m}{n}$,则混和气体的平均相对分子质量减小,故答案为:变小;
(3)充入氩气并保持压强不变,反应体系的压强减小,平衡逆向移动,故答案为:逆向;
(4)为放热反应,若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡向左移动,达到新平衡后,容器内温度小于原来的2倍,
故答案为:向左移动;小于;
(5)依据反应特征
N2+3H2=2NH3 △V
1 3 2 2
平衡体积 V V
即反应前后气体体积减小为生成氨气的体积,相同条件下,气体体积比等于气体物质的量之比,图象分析可知平衡状态氨气体积含量42%,设平衡混合气体体积为100,氨气为体积42,则反应前气体体积100+42=142,氮气和氢气按照1:3混合,氮气体积=142×$\frac{1}{4}$=35.5,依据化学方程式计算反应的氮气体积为21,平衡状态氮气为35.5-21=14.5,则氮气体积分数为14.5%,
故答案为:14.5%;
(6)在25℃下,平衡时溶液中c(NH4+)=c(Cl-)=0.005mol/L,根据物料守恒得n(NH3.H2O)=(0.5a-0.005)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,NH3•H2O的电离常数Kb=$\frac{c(O{H}^{-})c(N{{H}_{4}}^{+})}{c(N{H}_{3}.{H}_{2}O)}$=$\frac{1{0}^{-7}×5×1{0}^{-3}}{0.5a-5×1{0}^{-3}}$=$\frac{1{0}^{-9}}{a-0.01}$,
故答案为:$\frac{1{0}^{-9}}{a-0.01}$.
点评 本题考查化学平衡的计算,为高频考点,把握平衡三段法、平衡常数、平衡移动为解答的关键,侧重分析与计算能力的考查,注意差量法及电荷守恒应用,题目难度不大.


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 使用合适的催化剂可以加大反应速率 | |
| B. | 升高温度可以增大反应速率 | |
| C. | 增大N2浓度可以使H2转化率达到100% | |
| D. | 增大N2浓度可以减小反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用V(X)和V(Y)表示此反应的反应速率是:V(X)=V(Y)=(0.1-0.2a)mol•(L•min)-1 | |
| B. | 当混合气体的质量不再发生变化时,说明反应达到平衡状态,此时气体总量为(1+n)mol | |
| C. | 若建立平衡I的起始时n=1,维持温度和体积不变,向平衡I的体系中再加入cmolZ和dmolM[其中c>0的任意值,d≥(1-a)mol],达到平衡状态II,此时Y的体积分数一定为w% | |
| D. | 维持温度和体积不变,向上述平衡体系中再充入l mol X和n mol Y,此时v(正)增大,v(逆)减小,平衡正向移动,再次达到平衡时,Z的物质的量浓度为2a mol/L,M的物质的量为2a mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
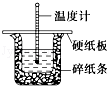 50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在图示的装置中进行中和反应,通过测定反应过程中的热量可计算中和热,回答下列问题:
50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在图示的装置中进行中和反应,通过测定反应过程中的热量可计算中和热,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数B>A>C | B. | 原子最外层电子数C>A>B | ||
| C. | 原子半径A>C>B | D. | 离子半径A+>B2->C3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com