
利用天然气可制得以H2、CO等为主要组成的工业原料合成气,反应为CH4(g)+H2O(g)
 CO(g)+3H2(g)。
CO(g)+3H2(g)。
(1)甲烷与水蒸气反应,被氧化的元素是____________,当生成标准状况下35.84 L合成气时转移电子的物质的量是________。
(2)将2 mol CH4和5 mol H2O(g)通入容积为100 L的反应室,CH4的平衡转化率与温度、压强的关系如图K235所示。
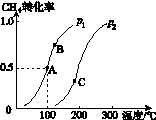
图K235
①若达到A点所需的时间为5 min,则v(H2)=________________________________________________________________________,
100 ℃时平衡常数K=____________________。
②图中的p1______p2(填“<”“>”或“=”),A、B、C三点的平衡常数KA、KB、KC的大小关系是________________________________________________________________________。
(3)合成气用于合成氨气时需除去CO,发生反应CO(g)+H2O(g) 
 CO2(g)+H2(g) ΔH<0,下列措施中能使
CO2(g)+H2(g) ΔH<0,下列措施中能使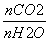 增大的是________(选填编号)。
增大的是________(选填编号)。
A.降低温度
B.恒温恒容下充入He(g)
C.将H2从体系中分离
D.再通入一定量的水蒸气
可用碳酸钾溶液吸收生成的CO2,常温下pH=10的碳酸钾溶液中由水电离的OH-的物质的量浓度为________________________________________________________________________,
常温下,0.1 mol·L-1 KHCO3溶液中pH>8,则溶液中c(H2CO3)________c(CO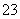 )(填“>”“=”或“<”)。
)(填“>”“=”或“<”)。
(1)C(碳) 2.4 mol
(2)①0.006 mol·L-1·min-1 6.75×10-4
②< KC>KB>KA
(3)AC 1×10-4mol·L-1 >
[解析] (1)在甲烷与水的反应中,碳元素的化合价由-4价升高到+2价,氢元素的化合价由+1价降低到0价,共转移6 mol电子,则被氧化的元素为碳元素,当生成气体1.6 mol(35.84 L)时,共转移电子2.4 mol。
(2)①在A点时甲烷的转化率为0.5,则转化的甲烷的物质的量为1 mol,生成的氢气的物质的量为3 mol,故v(H2)=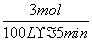 =0.006 mol·L-1·min-1;根据甲烷的平衡转化率可求得达到平衡时各物质的浓度为c(CH4)=0.01 mol·L-1,c(H2O)=0.04 mol·L-1,c(CO)=0.01 mol·L-1,c(H2)=0.03 mol·L-1,则K=
=0.006 mol·L-1·min-1;根据甲烷的平衡转化率可求得达到平衡时各物质的浓度为c(CH4)=0.01 mol·L-1,c(H2O)=0.04 mol·L-1,c(CO)=0.01 mol·L-1,c(H2)=0.03 mol·L-1,则K=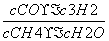 =
=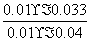 =6.75×10-4。
=6.75×10-4。
②在横轴上大约150 ℃处作垂直于横轴的直线,由此可看出在压强为p1时,甲烷的转化率高,而该反应的正反应为气体体积增大的反应,故压强越小,甲烷的转化率越高,故p1<p2;由图中任意一条曲线可看出,随着温度的升高,甲烷的转化率在增大,故正反应为吸热反应,而A、B、C三点温度越来越高,故平衡常数越来越大。
(3)该反应的正反应为放热反应,故降低温度平衡正向移动,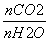 增大;恒温恒容时充入He气,平衡不移动,
增大;恒温恒容时充入He气,平衡不移动,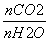 不变;将H2从体系中分离出来,平衡正向移动,
不变;将H2从体系中分离出来,平衡正向移动,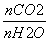 增大;再通入水蒸气,根据平衡移动原理可知
增大;再通入水蒸气,根据平衡移动原理可知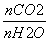 减小。K2CO3溶液中的OH-全部来自于水的电离,故c(OH-)水=1×10-4mol·L-1;在KHCO3溶液中存在平衡HCO
减小。K2CO3溶液中的OH-全部来自于水的电离,故c(OH-)水=1×10-4mol·L-1;在KHCO3溶液中存在平衡HCO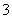 H++CO
H++CO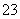 ,HCO
,HCO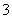 +H2OH2CO3+OH-,因溶液显碱性,故HCO
+H2OH2CO3+OH-,因溶液显碱性,故HCO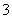 水解程度较大,故溶液中c(H2CO3)>c(CO
水解程度较大,故溶液中c(H2CO3)>c(CO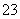 )。
)。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
某气态有机物100mL最多可跟100mL氯化氢发生加成反应,生成氯代烷。每0.5mol的该有机物最多可跟1.5mol Cl2发生取代反应,该有机物结构简式是( )
A.CH≡CH
B.CH2===CH2
C.CH2===CH—CH===CH2
D.CH2===CHCl
查看答案和解析>>
科目:高中化学 来源: 题型:
NH3经一系列反应可以得到HNO3和NH4NO3,如下图所示。
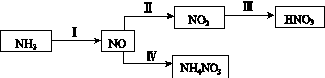
(1)Ⅰ中,NH3和O2在催化剂作用下反应,其化学方程式是_________________________。
(2)Ⅱ中,2NO(g)+O2(g)  2NO2(g)。在其他条件相
2NO2(g)。在其他条件相
同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线(如图)。
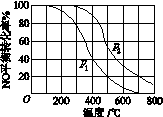
①比较p1、p2的大小关系:________。
②随温度升高,该反应平衡常数变化的趋势是________。
(3)Ⅲ中,降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸。
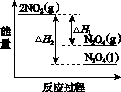
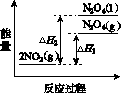
①已知:2NO2(g)  N2O4(g) ΔH1 2NO2(g)
N2O4(g) ΔH1 2NO2(g) N2O4(l) ΔH2
N2O4(l) ΔH2
下列能量变化示意图中,正确的是(选填字母)________。
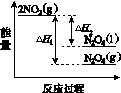
A B C
②N2O4与O2、H2O化合的化学方程式是________________________________________。
(4)Ⅳ中,电解NO制备NH4NO3,其工作原理如图所示。为使电解产物全部转化为NH4NO3,需补充A。A是________,说明理由:________________________________________。
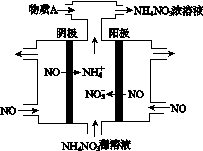
查看答案和解析>>
科目:高中化学 来源: 题型:
用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术。反应①为主反应,反应②和③为副反应。
①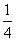 CaSO4(s)+CO(g)
CaSO4(s)+CO(g)
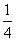 CaS(s)+CO2(g)
CaS(s)+CO2(g)
ΔH1=-47.3 kJ·mol-1
②CaSO4(s)+CO(g) CaO(s)+CO2(g)+SO2(g) ΔH2=+210.5 kJ·mol-1
CaO(s)+CO2(g)+SO2(g) ΔH2=+210.5 kJ·mol-1
③CO(g)
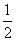 C(s)+
C(s)+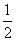 CO2(g) ΔH3=-86.2 kJ·mol-1
CO2(g) ΔH3=-86.2 kJ·mol-1
(1)反应2CaSO4(s)+7CO(g) CaS(s)+CaO(s)+6CO2(g) +C(s)+SO2(g)的ΔH=________(用ΔH1、ΔH2和ΔH3表示)。
CaS(s)+CaO(s)+6CO2(g) +C(s)+SO2(g)的ΔH=________(用ΔH1、ΔH2和ΔH3表示)。

(2)反应①~③的平衡常数的对数lg K随反应温度T的变化曲线如图所示。结合各反应的ΔH,归纳lg K~T曲线变化规律:
a.________; b.________。
(3)向盛有CaSO4的真空恒容密闭容器中充入CO,反应①于900 ℃达到平衡,c平衡(CO)=8.0×10-5mol·L-1,计算CO的转化率(忽略副反应,结果保留两位有效数字)。
(4)为减少副产物,获得更纯净的CO2,可在初始燃料中适量加入________。
(5)以反应①中生成的CaS为原料,在一定条件下经原子利用率100%的高温反应,可再生CaSO4,该反应的化学方程式为______________________________________,在一定条件下,CO2可与对二甲苯反应,在其苯环上引入一个羧基,产物的结构简式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业制硝酸的主要反应为
4NH3(g)+5O2(g)  4NO(g)+6H2O(g) ΔH。
4NO(g)+6H2O(g) ΔH。
(1)已知氢气的燃烧热为285.8 kJ/mol。
N2(g)+3H2(g)===2NH3(g) ΔH=-92.4 kJ/mol;
H2O(l)===H2O(g) ΔH=+44.0 kJ/mol;
N2(g)+O2(g)===2NO(g) ΔH=+180.6 kJ/mol。
则上述工业制硝酸的主要反应的ΔH=____________________。
(2)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
浓度 时间 | c(NH3)(mol/L) | c(O2)(mol/L) | c(NO)(mol/L) |
起始 | 0.8 | 1.6 | 0 |
第2 min | 0.6 | a | 0.2 |
第4 min | 0.3 | 0.975 | 0.5 |
第6 min | 0.3 | 0.975 | 0.5 |
第8 min | 0.7 | 1.475 | 0.1 |
①反应在第2 min到第4 min时,O2的平均反应速率为__________________。
②反应在第6 min时改变了条件,改变的条件可能是__________(填序号)。
A.使用催化剂 B.升高温度
C.减小压强 D.增加O2的浓度
③下列说法中能说明4NH3(g)+5O2(g)4NO(g)+6H2O(g)达到平衡状态的是________(填序号)。
A.单位时间内生成n mol NO的同时,生成n mol NH3
B.条件一定,混合气体的平均相对分子质量不再变化
C.百分含量w(NH3)=w(NO)
D.反应速率v(NH3)∶v(O2)∶v(NO)∶v(H2O)=4∶5∶4∶6
E.恒压条件下,混合气体的密度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
臭氧是理想的烟气脱硝试剂,其脱硝反应为2NO2(g)+O3(g)  N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
| A | B |
|
|
|
| 升高温度,平衡常数减小 | 0~3 s内,反应速率为 v(NO2)=0.2 mol·L-1 |
| C | D |
|
|
|
| t1时仅加入催化剂,平衡正向移动 | 达平衡时,仅改变x,则x为c(O2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
乙醇是重要的有机化工原料,可由乙烯气相直接水合法生产或间接水合法生产。回答下列问题:
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H),再水解生成乙醇。写出相应反应的化学方程式:________________________________________。
(2)已知:
甲醇的脱水反应
2CH3OH(g)===CH3OCH3(g)+H2O(g)
ΔH1=-23.9 kJ·mol-1
甲醇制烯烃的反应
2CH3OH(g)===C2H4(g)+2H2O(g)
ΔH2=-29.1 kJ·mol-1
乙醇的异构化反应 C2H5OH(g)===CH3OCH3(g)
ΔH3=+50.7 kJ·mol-1
则乙烯气相直接水合反应C2H4(g)+H2O(g)===C2H5OH(g)的ΔH________kJ·mol-1。与间接水合法相比,气相直接水合法的优点是____________________________________。
(3)如图所示为气相直接水合法中乙烯的平衡转化率与温度、压强的关系[其中n(H2O)∶n(C2H4)=1∶1]。
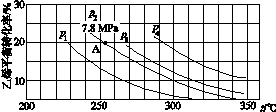
①列式计算乙烯水合制乙醇反应在图中A点的平衡常数Kp=____________________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
②图中压强(p1、p2、p3、p4)的大小顺序为____,理由是___________________。
③气相直接水合法常采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290 ℃、压强6.9 MPa,n(H2O)∶n(C2H4)=0.6∶1。乙烯的转化率为5%,若要进一步提高乙烯转化率,除了可以适当改变反应温度和压强外,还可采取的措施有________________________________________________________________________、
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
NH3经一系列反应可以得到HNO3和NH4NO3,如下图所示。
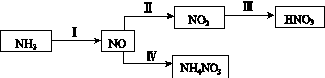
(1)Ⅰ中,NH3和O2在催化剂作用下反应,其化学方程式是_________________________。
(2)Ⅱ中,2NO(g)+O2(g)  2NO2(g)。在其他条件相
2NO2(g)。在其他条件相
同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线(如图)。

①比较p1、p2的大小关系:________。
②随温度升高,该反应平衡常数变化的趋势是________。
(3)Ⅲ中,降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸。
①已知:2NO2(g)  N2O4(g) ΔH1 2NO2(g)
N2O4(g) ΔH1 2NO2(g) N2O4(l) ΔH2
N2O4(l) ΔH2
下列能量变化示意图中,正确的是(选填字母)________。
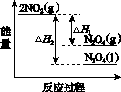
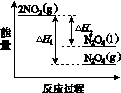
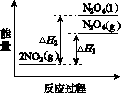
A B C
②N2O4与O2、H2O化合的化学方程式是________________________________________。
(4)Ⅳ中,电解NO制备NH4NO3,其工作原理如图所示。为使电解产物全部转化为NH4NO3,需补充A。A是________,说明理由:________________________________________。
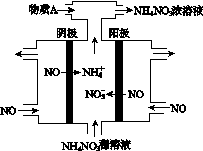
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应属于氧化还原反应的是
A.H2SO4+2NaOH=Na2SO4+2H2O B.2NaHCO3 △ Na2CO3+CO2↑+H2O
C.NH3+HCl=NH4C1 D.CuO+H2 △ Cu+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com