
 5Fe3++Mn2++4H2O。高锰酸钾标准溶液可用性质稳定、相对分子质量较大的基准物质草酸钠[Mr(Na2C2O4)=134.0]进行标定,反应原理为:5C2O42-+2MnO4-+16H+
5Fe3++Mn2++4H2O。高锰酸钾标准溶液可用性质稳定、相对分子质量较大的基准物质草酸钠[Mr(Na2C2O4)=134.0]进行标定,反应原理为:5C2O42-+2MnO4-+16H+ 10CO2↑+2Mn2++8H2O。
10CO2↑+2Mn2++8H2O。
| 平行实验编号 | Na2C2O4质量 (m) | 滴定管起始读数 (mL) | 滴定管滴定终点读数 (mL) | 消耗KMnO4溶液体积 (mL) |
| 1 | | | | |
| 2 | | | | |
| 3 | | | | |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题
| A.Fe(OH)3、Al(OH)3 | B.Al(OH)3、I2? |
| C.Fe2S3、I2 | D.FeS、S、Al(OH)3? |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
| 沸腾炉温度/℃ | 560 | 580 | 600 | 620 | 640 | 660 | |
| 生 成 物 | 水溶性Cu/% | 90.12 | 91.24 | 93.50 | 92.38 | 89.96 | 84.23 |
| 酸溶性Cu/% | 92.00 | 93.60 | 97.08 | 97.82 | 98.16 | 98.19 | |
| 酸溶性Fe/% | 8.56 | 6.72 | 3.46 | 2.78 | 2.37 | 2.28 | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.可表示为3YO3·3FeO·Fe2O3 | B.可表示为Y3O5·Fe3O4·Fe2O3 |
| C.其中钇、铁的化合价均为+3价 | D.其中钇、铁的化合价均有+2、+3价 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
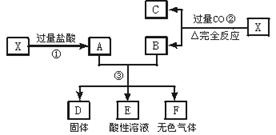
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.5:4 | B.4:5 | C.3:5 | D.5:6 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com