
【题目】金晶体的最小重复单元(也称晶胞)是面心立方体,即在立方体的8个顶点各有一个金原子,各个面的中心有一个金原子,每个金原子被相邻的晶胞所共有(如图)。金原子的直径为d,用NA表示阿伏加德罗常数,M表示金的摩尔质量。
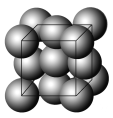
(1)金晶体每个晶胞中含有________个金原子。
(2)欲计算一个晶胞的体积,除假定金原子是刚性小球外,还应假定_______。
(3)一个晶胞的体积是多少?
(4)金晶体的密度是多少?
 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
【题目】运用元素周期律研究元素及其化合物的性质具有重要的意义.
(1)部分短周期主族元素的最高价氧化物对应的水化物(浓度均为0.01molL﹣1)溶液的PH和原子序数的关系如图所示. 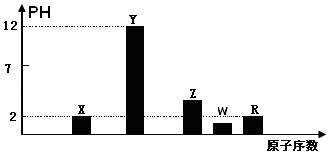
(i)元素R在周期表中的位置是
(ii)元素Y和W形成的Y2W2型化合物中含有化学键的类型为
(iii)请写出X的最高价氧化物对应的水化物与其气态氢化物的离子反应方程式
(2)短周期元素C、O、S能形成多种化合物,如CO2、CS2、COS等
(i)下列能说明碳、硫两种元素非金属性相对强弱的是(填序号)
A.S与H2发生化合反应比C与H2化合更容易
B.酸性:H2SO3>H2CO3
C.稳定性:CH4<H2S
(ii)羰基硫(COS)可作为一种熏蒸剂,能防止某些昆虫、线虫的危害,其分子结构和CO2相似
①羰基硫(COS)的电子式为:
②羰基硫(COS)用氢氧化钠溶液处理及利用的过程如图:
已知A是一种正盐,则反应I的化学反应方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是主要的化学工业基础原料和清洁液体燃料.工业上可以用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应及平衡常数 | 温度/℃ | ||
500 | 800 | ||
①2H2(g)+CO(g)CH3OH(g)△H1 | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g)CO(g)+H2O(g)△H2 | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g)CH3OH(g)+H2O(g)△H3 | K3 | ||
(1)反应②的反应热△H20(填“>”、“<”或“=”);
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图1所示.则平衡状态由A变到B时,平衡常数K(A)K(B) (填“>”、“<”或“=”);
(3)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=(用K1、K2表示).500℃时测得反应③在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol/L)分别为0.8、0.1、0.3、0.15,则此时v(正)v(逆) (填“>”、“<”或“=”);
(4)在3L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图2所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ.当曲线Ⅰ变为曲线Ⅱ时,改变的条件是;当曲线Ⅰ变为曲线Ⅲ时,改变的条件是; 
(5)一定条件下甲醇与一氧化碳反应可以合成乙酸.通常状况下,将amol/L的乙酸与bmol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO﹣),用含a和b的代数式表示该混合溶液中乙酸的电离常数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为1mol SO2Cl2(g)和1mol SCl2(g)反应生成SOCl2(g)过程中的能量变化示意图,已知E1=x kJmol﹣1、E2=y kJmol﹣1 , 下列有关说法中正确的是( ) 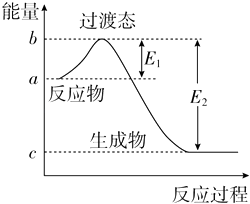
A.若在反应体系中加入催化剂,E1不变
B.若在反应体系中加入催化剂,△H减小
C.反应的活化能等于y kJmol﹣1
D.1 mol SO2Cl2(g)和1 mol SCl2(g)反应生成SOCl2(g)的△H=(x﹣y) kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质均能实现的是( )
A.Fe ![]() Fe2O3
Fe2O3 ![]() Fe2(SO4)3
Fe2(SO4)3
B.N2 ![]() NO2
NO2 ![]() HNO3
HNO3
C.S ![]() SO2
SO2 ![]() H2SO4
H2SO4
D.AgNO3(aq) ![]() Ag(NH3)2OH(aq)
Ag(NH3)2OH(aq) ![]() Ag
Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某蛋白质分子的结构示意图,图中α链由21个氨基酸组成,β链由19个氨基酸组成,图中“-S-S-”是在蛋白质加工过程中由两个“-SH”脱下2个H形成的。下列有关叙述中,错误的是( )
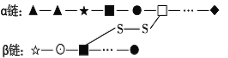
A.蛋白质多样性的原因包括氨基酸的排列顺序不同
B.该蛋白质含有40种氨基酸
C.该蛋白质分子中至少含有42个O原子
D.形成该蛋白质分子时相对分子质量减少了686
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是
A.18gD2O中含有的中子数为10NA
B.常温常压下,49氦气中所含原子数为2NA
C.标准状况下,22.4LCH3CI中含C-H键数为3NA
D.1L0.3mol/LNH4NO3中所含NH4+数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示有关蛋白质分子的简要概念图,分析图示回答下列问题:
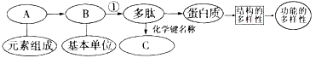
(1)此图中B代表__________,大约有______种,其分子结构通式为__________,C代表_______,其结构式是________。
(2)某蛋白质由104个氨基酸构成的含有四条肽链,在氨基酸形成该蛋白质过程中相对分子质量减少了__________。
(3)若该蛋白质是血红蛋白,说明蛋白质具有__________作用;若该蛋白质是酶,说明蛋白质具有__________作用;造成蛋白质功能多样性的原因(试从氨基酸的角度分析)_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是配制250mL0.2mol·L-1氯化钠溶液的步骤:
①溶解②洗涤③移液④计算⑤定容⑥称量⑦盖好瓶塞,反复上下颠倒,摇匀。请你选出该溶液配制的操作先后顺序是
A. ②③⑤①⑥⑦④ B. ④⑥①③②⑤⑦
C. ④②⑤⑥①③⑦ D. ②⑥⑦④③⑤①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com