
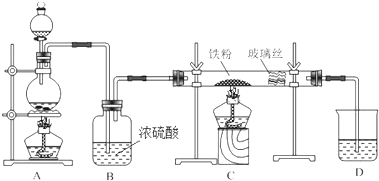
分析 由题给信息可知,题中装置可用于制备氯化铁或氯化亚铁,如制备氯化亚铁,A用于制备HCl,B为干燥装置,在C中生成氯化亚铁,D为尾气处理装置,如制备氯化铁,A用于制备氯气,应先分别除去HCl、水后再在C中生成氯化铁,且C、D之间添加干燥装置,防止氯化铁水解,D为尾气处理装置,以此解答该题.
解答 解:(1)检验该装置气密性的方法:关闭分液漏斗的活塞,D总导气管插入水中,用酒精灯微热烧瓶,D中导气管口有气泡冒出,停止加热后,导气管内有一段上升的水柱,证明装置的气密性良好;
故答案为:关闭分液漏斗的活塞,D中导管插入水中,用酒精灯微热烧瓶,D中导管口有气泡冒出,停止加热后,导管内有一段上升的水柱,证明装置气密性良好;
(2)MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑,反应中二氧化锰中的锰元素化合价降低,所以二氧化锰为氧化剂,氯化氢中氯元素部分化合价升高到氯气中的0价,部分氯元素化合价不变,所以盐酸在反应中表现为酸性和还原性,对应产物氯气为氧化产物,生成标况下11.2L Cl2,即0.5mol氯气,则转移1mol电子,转移的电子数为6.02×1023,
故答案为:MnO2;Cl2;6.02×1023;
(3)由题给信息可知制取无水氯化亚铁的实验中,装置A用来制取HCl,故答案为:HCl;
(4)如制备氯化铁,A用于制备氯气,应先分别除去HCl、水后再在C中生成氯化铁,且C、D之间添加干燥装置,防止氯化铁水解,
故答案为:A与B之间缺少一个除去氯化氢的装置;C和D之间缺少一个干燥装置.
点评 本题以氯化铁以及氯化亚铁的制取为载体,为高考常见题型,侧重于学生的分析、实验能力的考查,考查的是实验室中氯气的制取方法、常见尾气的处理方法,明确氯气制备原理和性质是解题关键,题目难度中等.


 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 目标物质和杂质 | 检验方法 | 除杂方法 |
| A | FeCl2(FeCl3) | 滴入KSCN | 通入过量氯气 |
| B | NaCl(NH4Cl) | 加热 | 加热 |
| C | KNO3(NaCl) | 焰色反应(透过蓝色钴玻璃) | 重结晶 |
| D | Cl2(HCl) | 通入AgNO3溶液 | 通入饱和NaCl溶液中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙酸和乙醇反应的装置如图所示:在试管里加入3mL乙醇,然后一边搅动,一边慢慢地加入2mL浓硫酸和2mL冰醋酸,用酒精灯小心均匀地加热10min,将产生的蒸气经长导管通入到小试管中溶液的液面上.
乙酸和乙醇反应的装置如图所示:在试管里加入3mL乙醇,然后一边搅动,一边慢慢地加入2mL浓硫酸和2mL冰醋酸,用酒精灯小心均匀地加热10min,将产生的蒸气经长导管通入到小试管中溶液的液面上.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
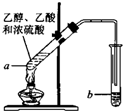 (1)在实验室可使用如图装置制取乙酸乙酯,请回答下列问题:
(1)在实验室可使用如图装置制取乙酸乙酯,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
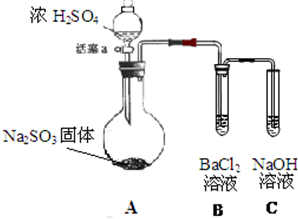 某同学设计了如下实验装置图.(夹持装置和加热装置略,气密性已检验):
某同学设计了如下实验装置图.(夹持装置和加热装置略,气密性已检验):查看答案和解析>>
科目:高中化学 来源: 题型:解答题
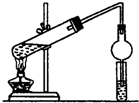 根据题目要求,回答下列问题:
根据题目要求,回答下列问题: CH3COOC2H5+H2O.装置中干燥管的作用是防止倒吸,小试管中的试剂为饱和碳酸钠溶液.
CH3COOC2H5+H2O.装置中干燥管的作用是防止倒吸,小试管中的试剂为饱和碳酸钠溶液.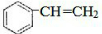 .在一定条件下,A发生聚合反应得到一种高分子化合物,该反应的化学方程式为
.在一定条件下,A发生聚合反应得到一种高分子化合物,该反应的化学方程式为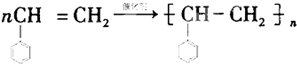 .A与氢气完全加成后产物的一氯代物共有5种.
.A与氢气完全加成后产物的一氯代物共有5种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
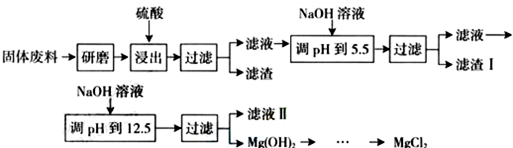
| 沉淀物 | Fe3+ | Al3+ | Mg2+ |
| pH | 3.2 | 5.2 | 12.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com