

分析 (1)该配合物中阳离子是Cu+,Cu原子失去1个电子生成Cu+,其原子核外有28个电子,根据构造原理书写亚铜离子核外电子排布式;
(2)原子个数相等、价电子数相等的微粒互为等电子体;同一周期元素,元素第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素;
(3)该配合物中每个Cl原子含有两个孤电子对和两个共价键,其价层电子对个数是4,根据价层电子对互斥理论判断Cl原子杂化方式;配位键由提供孤电子对的原子指向提供空轨道的原子;
(4)根据图知,该晶胞中距离每个Cu+最近的Cl-的个数为4.
解答 解:(1)该配合物中阳离子是Cu+,Cu原子失去1个电子生成Cu+,其原子核外有28个电子,根据构造原理书写亚铜离子核外电子排布式为1s22s22p63s23p63d10或[Ar]3d10,故答案为:1s22s22p63s23p63d10或[Ar]3d10;
(2)原子个数相等、价电子数相等的微粒互为等电子体,CO分子中含有2个原子、价电子数是10,与CO互为等电子体的微粒有CN-或C22-;同一周期元素,元素第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,第二周期元素中,第一电离能介于B、N之间的元素除C外,还有Be、O,
故答案为:CN-或C22-;Be和O;
(3)该配合物中每个Cl原子含有两个孤电子对和两个共价键,其价层电子对个数是4,根据价层电子对互斥理论判断Cl原子杂化方式为sp3;配位键由提供孤电子对的原子指向提供空轨道的原子,该配合物中Cu原子提供空轨道、C和Cl原子提供孤电子对,且Cu原子配位数是4,其配位键为 ;
;
故答案为:sp3; ;
;
(4)根据图知,该晶胞中距离每个Cu+最近的Cl-的个数为4,氯离子的配位数是4.故答案为:4.
点评 本题考查晶胞计算、原子杂化方式判断、等电子体、原子核外电子排布等知识点,为高频考点,侧重考查学生知识运用能力及空间想象能力,易错点是价层电子对个数的计算方法,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,H+、NH4+、SO42-、Br-可以大量共存 | |
| B. | 该溶液中,Ag+、K+、NO${\;}_{3}^{-}$、CH3CHO不能大量共存 | |
| C. | 向该溶液中滴入少量FeSO4溶液,反应的离子方程式为:2Fe2++ClO-+2H+═Cl-+2Fe3++H2O | |
| D. | 向该溶液中加入浓盐酸,每产生22.4LCl2,转移电子约为6.02×1023个 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 分子式为H2O和D2O的性质相同 | |
| B. | 相同条件下,等质量的碳按a、b两种途径完全转化,途径a和途径b放出的热能相等 途径a:C$→_{高温}^{H_{2}O}$CO+H2$→_{燃烧}^{O_{2}}$CO2+H2O,途径b:C$→_{燃烧}^{O_{2}}$CO2 | |
| C. | PM 2.5是指大气中直径接近2.5×10-6m的颗粒物,分散在空气中形成胶体 | |
| D. | 氢氧燃料电池的能量转换形式仅为化学能转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
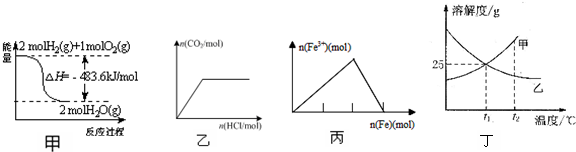
| A. | 甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ•mol-1 | |
| B. | 乙表示向Na2CO3溶液中逐滴滴加稀盐酸,生成CO2与所加盐酸物质的量的关系 | |
| C. | 丙表示在稀硝酸溶液中加入铁粉,溶液中Fe3+浓度的变化曲线 | |
| D. | 丁表示t1℃时质量分数均为20%的甲、乙两种溶液,升温到t2℃时,两种溶液中溶质的质量分数仍然相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液中加入过量氨水:A13++4NH3•H2O═4NH4++2H2O+A1O2- | |
| B. | 氯化亚铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O | |
| C. | NaHCO3溶液和过量的Ba(OH)2溶液混合:2HCO3-+OH-+Ba2+═BaCO3↓+2H2O+CO32- | |
| D. | 用氨水吸收少量二氧化硫:2NH3•H2O+SO2═2NH4++SO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32g | |
| B. | 1 mol Na2O2固体中含离子总数为4NA | |
| C. | 1mol羟基与17 g NH3所含电子数之比为9:10 | |
| D. | 1mol Na2CO3晶体中含 CO${\;}_{3}^{2-}$离子数小于1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22 g 2H218O中含有的质子数为10NA | |
| B. | 电解58.5 g熔融的NaCl,能产生11.2 L氯气(标准状况)、23.0 g金属钠 | |
| C. | 1.00 mol NaCl中,所有Na+的最外层电子总数为10NA | |
| D. | 1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com